
分析 根据反应方程式Zn+2FeCl3═ZnCl2+2FeCl2,参加反应的n(FeCl3)=0.5mol/L×0.1L=0.05mol,计算生成ZnCl2的物质的量,进而计算其浓度;有1mol氯化铁反应转移电子1mol,据此分析.
解答 解:根据反应方程式Zn+2FeCl3═ZnCl2+2FeCl2,参加反应的n(FeCl3)=0.5mol/L×0.1L=0.05mol,则生成n(ZnCl2)=$\frac{0.05mol}{2}$=0.025mol,所以c(ZnCl2)=$\frac{0.025mol}{0.1L}$=0.25mol/L;
有1mol氯化铁反应转移电子1mol,0.05mol氯化铁反应转移电子的物质的量为0.05mol,
答:溶液中ZnCl2的物质的量浓度是0.25mol/L;导线上通过的电子的物质的量是0.05mol.
点评 本题考查化学方程式的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,计算的关键是搞清反应原理.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:选择题
| A. | 与钠反应放出氢气 | B. | 能与新制的Cu(OH)2悬浊液反应 | ||
| C. | 能与新制银氨溶液发生银镜反应 | D. | 能发生加聚反应生成高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2OH+CH3COOH$→_{△}^{催化剂}$ CH3COOCH2CH3+H2O | |
| B. | 2CH3CHO+O2 $→_{△}^{催化剂}$2CH3COOH | |
| C. | CH3-CH=CH2+Br2→CH3-CHBr-CH2Br | |
| D. |  +Br2 $\stackrel{Fe}{→}$ +Br2 $\stackrel{Fe}{→}$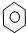 -Br+HBr -Br+HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 有关元素X、Y、Z、D、E的信息如表
有关元素X、Y、Z、D、E的信息如表| 元素 | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 原子半径为0.102nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物既能溶于强酸又能溶于强碱 |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
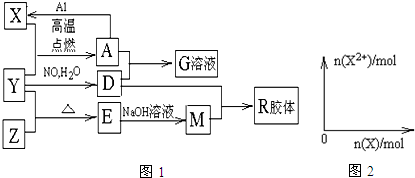
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池在放电时,Ag电极是电池的负极 | |
| B. | 充电时阳极发生的电极反应是:2Ag+2OH--2e-═Ag2O+H2O | |
| C. | 该电池可用酸作电解质溶液 | |
| D. | 充电时电流从Zn电极经电解质溶液流向外接电源的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
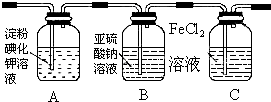
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量洗气瓶B中溶液于试管A中,滴加过量2 mol/LHCl和1 mol/LBaCl2溶液,振荡. | 若产生的白色沉淀,则洗气瓶B溶液中存在SO42-. |
| 步骤2:另取适量洗气瓶B中溶液于试管B中,滴加过量l mol/LBa(NO3)2溶液,振荡,静置. | 产生白色沉淀. |
| 步骤3:取步骤2后试管B中的上层清液于试管C中,滴加0.1mol/LAgNO3溶液和过量的2mol/LHNO3,振荡. | 若产生白色沉淀,则洗气瓶B溶液中存在Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 分子式 | 中心原子杂化方式 | 价层电子对互斥模型 | 分子或离子立体构型 |
| A | SO2 | sp | 直线形 | 直线形 |
| B | HCHO | sp2 | 平面三角形 | 三角锥形 |
| C | NF3 | sp2 | 四面体形 | 平面三角形 |
| D | NH4+ | sp2 | 正四面体形 | 正四面体形 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 氢气体积/mL | 0 | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com