
【题目】用 NA 表示阿伏加德罗常数的值,下列说法中正确的是( )
①1mol Na2O 和 Na2O2 混合物中含有的阴、阳离子总数是 3NA
②常温常压下,92g的NO2和N2O4 混合气体含有的原子数为 6NA
③7.8 g![]() 中含有的碳碳双键数目为 0.3 NA
中含有的碳碳双键数目为 0.3 NA
④用 1L1.0 mol/LFeCl3 溶液制备氢氧化铁胶体,所得氢氧化铁胶粒的数目为 NA
⑤1mol SO2与足量O2在一定条件下充分反应生成 SO3,共转移 2NA个电子
⑥在反应 KIO3+6HI=KI+3I2+3H2O 中,每生成 3molI2 转移的电子数为 5NA
A.①②③B.②③④C.①②⑥D.④⑤⑥
【答案】C
【解析】
①Na2O和Na2O2中阴、阳离子个数之比都为1:2,1mol Na2O和Na2O2混合物中含有的阴、阳离子总物质的量为3mol,阴、阳离子总数是 3NA,故①正确;
②NO2和N2O4的实验式都是NO2,n(NO2)=![]() =2mol,常温常压下92g的NO2和N2O4混合气体中所含原子物质的量为6mol,含有的原子数为 6NA,故②正确;
=2mol,常温常压下92g的NO2和N2O4混合气体中所含原子物质的量为6mol,含有的原子数为 6NA,故②正确;
③苯中不含碳碳双键,故③错误;
④n(FeCl3)=1.0mol/L×1L=1mol,根据反应FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl,生成1molFe(OH)3,氢氧化铁胶粒是一定数目Fe(OH)3的集合体,氢氧化铁胶粒的物质的量小于1mol,氢氧化铁胶粒的数目小于 NA,故④错误;
Fe(OH)3(胶体)+3HCl,生成1molFe(OH)3,氢氧化铁胶粒是一定数目Fe(OH)3的集合体,氢氧化铁胶粒的物质的量小于1mol,氢氧化铁胶粒的数目小于 NA,故④错误;
⑤若1molSO2全部反应则转移2mol电子,而SO2与O2的反应是可逆反应,1molSO2与足量O2在一定条件下充分反应生成SO3,转移电子物质的量小于2mol,转移电子数小于2NA,故⑤错误;
⑥用双线桥分析该反应: ,每生成3molI2转移5mol电子,转移的电子数为 5NA,故⑥正确;
,每生成3molI2转移5mol电子,转移的电子数为 5NA,故⑥正确;
①②⑥正确,故答案选C。


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )

A. Mg 电极是该电池的正极
B. H2O2在石墨电极上发生氧化反应
C. 石墨电极附近溶液的pH 增大
D. 溶液中Cl-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在有机物:①CH3CH3、②CH2=CH2、③CH3CH2C≡CH、④CH3C≡CCH3、⑤C2H6、⑥CH3CH=CH2中,一定互为同系物的是_______,一定互为同分异构体的是________________(填编号);
(2)以五倍子为原料可制得A,A结构简式为下图所示,回答下列问题:
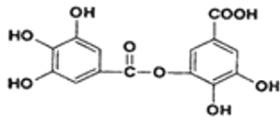
①A的分子式为______________;
②有机化合物B在硫酸催化条件下加热发生酯化可得到A。写出B的结构简式为_____ ;
(3)写出含有1个-CH2-、1个![]() 、3个-CH3原子团的烃类物质的结构简式___________;
、3个-CH3原子团的烃类物质的结构简式___________;
(4)写出核磁共振氢谱有两组峰,且峰面积之比为3:2,分子式为C8H10的芳香烃类化合物的结构简式_________;
(5)写出该有机物的名称![]() ________________。
________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
|
|
|
|
A.4.03米大口径碳化硅反射镜 | B.2022年冬奥会聚氨酯速滑服 | C.能屏蔽电磁波的碳包覆银纳米线 | D.“玉兔二号”钛合金筛网轮 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾。工艺流程如下:回答下列问题:
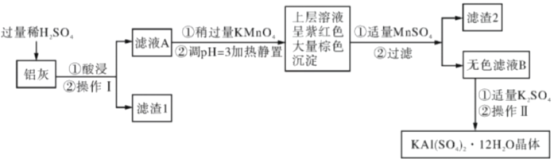
(1)明矾净水的原理是____________(用离子方程式表示)。
(2)操作Ⅱ是蒸发浓缩、__________、过滤、__________、干燥,
(3)检验滤液A中是否存在Fe2+的试剂是________________(只用一种试剂)。
(4)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是_________,在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4-转化为Mn2+):________
(5)已知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:_________________,滤渣2含有的物质是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体化合物X由3种元素组成。某学习小组进行了如下实验:
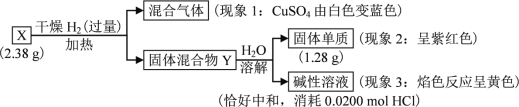
请回答:
(1) 由现象1得出化合物X含有________元素(填元素符号)。
(2) 固体混合物Y的成分________(填化学式)。
(3) X的化学式________。X与浓盐酸反应产生黄绿色气体,固体完全溶解,得到蓝色溶液,该反应的化学方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知五种短周期元素的原子序数的大小顺序为C>A>B>D>E;A、C同周期,B、C同主族;A与B形成的离子化合物A2B中,所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子分子。试回答下列问题:
(1)写出对应元素的名称:A_____,C_____,E_____。
(2)写出下列物质的电子式:
①D元素形成的单质____;②A、B、E形成的化合物____;③D、E形成的化合物______。
(3)A和B可形成A2B、A2B2两种化合物,E与B可形成E2B、E2B2两种化合物,则下列说法不正确的是_____。
A.A2B2和E2B2中都含有非极性共价键
B.A2B和E2B都含离子键
C.A2B和A2B2中阴阳离子个数比均为1∶2
D.A2B和A2B2均能溶于E2B,并发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是( )
A.2SO2+O2=2SO3 ΔH=-196.6kJ·mol-1
B.H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8kJ
O2(g)=H2O(l) ΔH=-285.8kJ
C.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
D.C(s)+O2(g)=CO2(g) ΔH=393.5kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理或操作正确的是
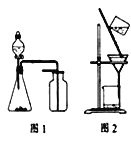
A.用广泛pH试纸测得0.1 molL-1 NH4Cl溶液的pH=5.2
B.选择合适的试剂,用图1装置可分别制取和收集少量CO2、NO
C.除去石英(主要成分SiO2)中少量碳酸钙:用稀盐酸溶解后用图2装置过滤
D.洗涤沉淀时(见图2),向漏斗中加适量水,搅拌并滤干
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com