
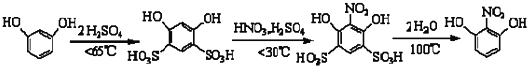
| 名称 | 相对分子质量 | 性状 | 熔点 | 水溶性(常温) |
| 间苯二酚 | 110 | 白色针状晶体 | 110.7 | 易容 |
| 2-硝基-1,3-苯二酚 | 155 | 桔红色针状晶体 | 87.8 | 难溶 |
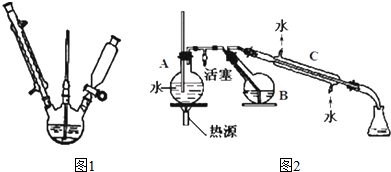
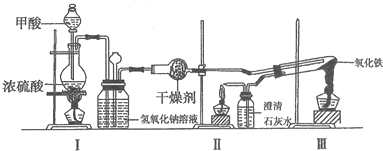
分析 (1)实验室中把固体碾成粉末一般用研钵;
(2)为控制适当的反应速率及防止副产物出现,反应温度一般控制在60~65℃左右;
(3)硝化步骤中制取“混酸”的操作与浓硫酸的稀释相似,要防止硝酸挥发及暴沸,应将浓硫酸加入到硝酸中;
(4)图2中,烧瓶A中长玻璃管起稳压作用,既能防止装置中压强过大引起事故,又能防止压强过小产生倒吸,根据反应原理,在直形冷凝管C中应出现2-硝基-1,3-苯二酚,被冷却后以固体形式出现,据此判断现象;
(5)能用水蒸气蒸馏来分离和提纯物质,则被提纯物质必须不溶或难溶于水,便于最后分离、在沸腾下与水不发生化学反应、具有一定的挥发性,据此选择;
(6)根据产率=$\frac{实际产量}{理论产量}$×100%计算.
解答 解:(1)实验室中把固体碾成粉末一般用研钵,故答案为:研钵;
(2)为控制适当的反应速率及防止副产物出现,反应温度一般控制在60~65℃左右,故选B;
(3)硝化步骤中制取“混酸”的操作与浓硫酸的稀释相似,要防止硝酸挥发及暴沸,应将浓硫酸加入到硝酸中,其操作为在锥形瓶中加适量的浓硝酸,在摇荡下缓慢加入一定量的浓硫酸,冷却,
故答案为:在锥形瓶中加适量的浓硝酸,在摇荡下缓慢加入一定量的浓硫酸,冷却;
(4)图2中,烧瓶A中长玻璃管起稳压作用,既能防止装置中压强过大引起事故,又能防止压强过小产生倒吸,根据反应原理,在直形冷凝管C中应出现2-硝基-1,3-苯二酚,被冷却后以固体形式出现,所以直形冷凝管C中的现象是有桔红色晶体析出,
故答案为:压强过小产生倒吸;有桔红色晶体析出;
(5)能用水蒸气蒸馏来分离和提纯物质,则被提纯物质必须不溶或难溶于水,便于最后分离、在沸腾下与水不发生化学反应、具有一定的挥发性,故选abc;
(6)71.5g间苯二酚的物质的量为0.65mol,根据元素守恒可知,生成的2-硝基-1,3-苯二酚的质量为0.65mol×155g/mol=100.75g,产率=$\frac{实际产量}{理论产量}$×100%=$\frac{12.0g}{100.75g}$×100%=11.9%,
故答案为:11.9%.
点评 本题考查有机物合成实验、物质的分离与洗涤等基本操作、对实验装置的分析评价等,较好的考查学生对数据的应用、阅读获取信息的能力以及知识迁移应用,难度中等.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
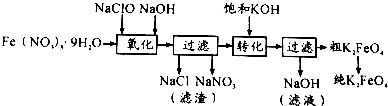
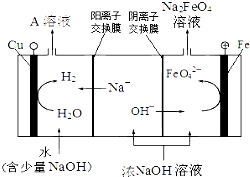
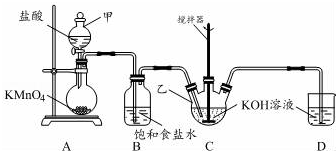 实验室用图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4.
实验室用图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 制备方法 | 具体内容 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与KClO反应生成紫红色高铁酸钾溶液 |
| 电解法 | 电解浓NaOH溶液制备Na2FeO4 |
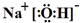 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 加热方式 | 产物元素组成 | 各元素的质量分数% | |
| Fe | O | ||
| 酒精灯 | Fe和O | 74.50 | 25.50 |
| 带网罩酒精灯 | Fe和O | 76.48 | 23.52 |
| 酒精喷灯 | Fe | 100.00 | 0.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C+O2 $\frac{\underline{\;点燃\;}}{\;}$CO2 化合反应 | |
| B. | CaCO3$\frac{\underline{\;点燃\;}}{\;}$ CaO+CO2↑分解反应 | |
| C. | AgNO3+KCl═AgCl↓+KNO3复分解反应 | |
| D. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 置换反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com