
【题目】短周期元求X、Y、W在元素周期表中的相对位置如下图所示,其中Z为地壳中含量最高的金属元素。下列说法正确的是
X | ||||||
Y | Z | W |
A.工业上电解YW饱和溶液冶炼金属Y
B.气态氢化物的稳定性:W>X
C.简单离子半径的大小顺序:r(Y+)>r(X-)
D.Y、W的最高价氧化物的水化物均能溶解金厲Z
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 由非金属元素组成的化合物不可能是离子化合物
B. 金属原子与非金属原子之间也可以形成共价键
C. 离子化合物中可能含有共价键
D. 共价化合物中不可能含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:有机物A的产量可以用来衡量一个国家的石油化工发展水平。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。

(1)A分子中官能团的名称是 ,D中官能团的名称是________反应①的反应类型是 反应。
(2)反应②的化学方程式是 。
反应④的化学方程式是 。
(3)E是常见的高分子材料,合成E的化学方程式是 。
(4)某同学用如图所示的实验装置制取少量乙酸乙酯。实验结束后,试管甲中上层为透明的、不溶于水的油状液体。

① 实验开始时,试管甲中的导管不伸入液面下的原因是 。
②上述实验中饱和碳酸钠溶液的作用是(填字母) 。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
③在实验室利用B和D制备乙酸乙酯的实验中,若用1mol B和1mol D充分反应,__________(能/不能)生成1mol 乙酸乙酯,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请用化学用语回答:

(1)最高价氧化物对应的水化物中酸性最强的是 。
(2)实验室制取②的氢化物的化学方程式 。
(3)④和⑤元素最高价氧化物对应的水化物相互反应的化学方程式 。
(4)元素②、⑥与氢元素形成的一种化合物含有的化学键类型有 ,其电子式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | HCl ②________ | ③________ ④Ba(OH)2 | ⑤Na2CO3 ⑥______ | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
(1)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在上表中②③⑥的后面。
(2)写出实验室由⑩制备O2的化学方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元索周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是
A.原子半径:Z>W>X>Y
B.最高价氧化物对应水化物的酸性:X>W>Z
C.最简单气态氢化物的热稳定性 :Y>X>W>Z
D.元素X、Z、W、Y的最高化合价都分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
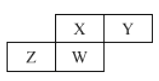
【题目】某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)。
![]()
(1)甲、乙两仪器的名称是 、
(2)A、C、E相连后的装置可用于制取Cl2,写出A中发生反应的化学方程式 ,将Cl2通入含有酚酞的NaOH溶液中的现象是 ,该反应的离子方程式为 。
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(铜片放在有孔塑料板上),可制得NO2并进行有关实验。
①写出该反应的离子方程式 。
②欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹 ,再打开止水夹 ,使烧杯中的水进入试管丁中。
③试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是 mol·L1(保留2位有效数值,气体按标准状况计算)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。回答下列问题:
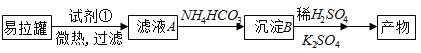
(1)为尽量少引入杂质,试剂①应选用__________(填序号)
A.NaOH溶液 B.H2SO4溶液 C.氨水 D.HCl溶液
(2)易拉罐溶解过程中主要反应的化学方程式为______________;
(3)由滤液A生成沉淀B反应的离子方程式为:_________________;
(4)明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀,离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的密闭容器中进行如下反应:
A(g)+2B(g)![]() 3C(g)+nD(g),开始时A为4mol,B为6mol;5min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算
3C(g)+nD(g),开始时A为4mol,B为6mol;5min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算
(1)5min末A的物质的量浓度为__________ mol/L·
(2)前5min内用B表示的化学反应速率v(B)为___________ mol/(L·min)。
(3)化学方程式中n值为__________。
(4)此反应在四种不同情况下的反应速率分别为:
①v(A)=5mol/(L·min)
②v(B)=6mol/(L·min)
③v(C)=4.5mol/(L·min)
④v(D)=8mol/(L·min)
其中反应速率最快的是__________(填编号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com