
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |



科目:高中化学 来源: 题型:
| A、1:2 | B、1:4 |
| C、3:4 | D、3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、n=2,H2O是氧化产物 |
| B、x=y=m=4 |
| C、该反应中R2+得到电子,被氧化为R3+ |
| D、任何氧化还原反应中氧化剂失电子总数都等于还原剂得电子总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
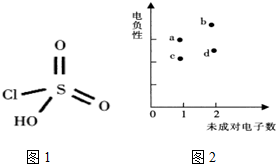 纯钛烤瓷牙是近几年才发展成熟的金属烤瓷技术,过氧硫酸被用于假牙的消毒.过氧硫酸可由氯磺酸通过反应I制得,氯磺酸结构如图1.
纯钛烤瓷牙是近几年才发展成熟的金属烤瓷技术,过氧硫酸被用于假牙的消毒.过氧硫酸可由氯磺酸通过反应I制得,氯磺酸结构如图1.查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应1 |
| 反应2 |
| 反应3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)已知在一定条件下的反应4HCl+O2=2Cl2+2H2O中,有4mol HCl被氧化时,放出
(1)已知在一定条件下的反应4HCl+O2=2Cl2+2H2O中,有4mol HCl被氧化时,放出| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ?mol-1) | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com