
【题目】下列有机化合物中,都有多个官能团:

(1)可以看作醇类的是(填入编号,下同) ______。
(2)可以看作酚类的是 ______。
(3)可以看作羧酸类的是 ______。
(4)可以看作酯类的是 ______。
(5)可以看作醛类的是 ______。
【答案】BD ABC BCD E A
【解析】
依据官能团的特征和性质进行判断和识别。—OH和链烃基相连则可看作醇类;—OH和苯环相连时,可看作酚类;含有—COOH官能团的,可看作羧酸;含有—CHO官能团的,可看作醛类;含有“![]() ”结构,两端和烃基相连,即含
”结构,两端和烃基相连,即含![]() ′这种结构的物质,可看作酯类;据此答题。
′这种结构的物质,可看作酯类;据此答题。
A.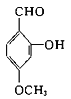 中含有的官能团为醛基,酚羟基,醚基;
中含有的官能团为醛基,酚羟基,醚基;
B.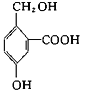 中含有的官能团为羧基,酚羟基,醇羟基;
中含有的官能团为羧基,酚羟基,醇羟基;
C.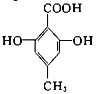 中含有的官能团为羧基,酚羟基;
中含有的官能团为羧基,酚羟基;
D.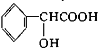 中含有的官能团为羧基,醇羟基;
中含有的官能团为羧基,醇羟基;
E.![]() 中含有的官能团为碳碳双键,酯基。
中含有的官能团为碳碳双键,酯基。
(1)可以看作醇类的是BD,故答案为:BD。
(2)可以看作酚类的是ABC,故答案为:ABC。
(3)可以看作羧酸类的是BCD,故答案为:BCD。
(4)可以看作酯类的是E,故答案为:E。
(5)可以看作醛类的是A,故答案为:A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组进行电解原理的实验探究,实验如下:一定温度下,以铜为电极,按如图所示装置电解饱和食盐水,通电2min。实验现象:接通电源30s内,阳极附近出现白色浑浊,之后变为橙黄色浑浊,此时测定溶液的pH约为10。结束后(温度不变),试管底部聚集大量红色沉淀,溶液仍为无色。

查阅资料:
物质 | 氯化铜 | 氧化亚铜 | 氢氧化亚铜(不稳定) | 氯化亚铜 |
颜色 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 红色 | 橙黄色 | 白色 |
下列说法错误的是( )
A. 反应结束后,最终溶液一定呈碱性
B. 反应过程中发生了沉淀转化,说明Ksp(CuOH)<Ksp (CuCl)
C. 阴极的电极反应式为2H2O+2e-=H2↑+2OH-
D. 电解过程中,Cl-移向阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学能与电能可相互转化,根据下图回答问题。
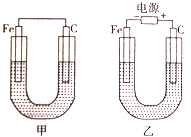
(1)若两装置中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲装置中的______棒,乙装置中的____________棒。(填“铁”或“碳”)
②乙装置中阳极上发生的电极反应式为________________________。
(2)若两装置中均为饱和NaCl溶液:
①甲装置中碳棒上电极反应属于_________________(填“氧化反应”或“还原反应”)。
②乙装置中反应的化学方程式为 __________________。
③若乙装置转移0.1mole-后停止实验,且溶液体积为1L,则溶液混匀后的c(OH-)=_____。(不考虑所生成气体在溶液中的溶解)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对文中描述内容的相关解释正确的是( )
选项 | 描述 | 解铎 |
A | 丹砂烧之成水银,积变又还成丹砂 | 两个反应互为可逆反应 |
B | 凡埏泥造瓦,掘地二尺余,择取无沙粘土而为之 | 其中“瓦”的主要成分为硅酸盐 |
C | 硝石(KNO3)如握盐雪不冰,强烧之,紫青烟起 | 产生“紫青烟”的原因为KNO3分解 |
D | 其法用浓酒精和槽入瓶,蒸令气上,用器承滴露 | 其中涉及的操作方法为蒸发浓缩 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中,800℃时反应2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)该反应平衡常数的表达式为K=_______________A点处,v(正) ______ v(逆),A点正反应速率 ______ B点正反应速率(用“大于”、“小于”或“等于”填空).
(2)图中表示O2变化的曲线是 ______ .用NO2表示从0~2s内该反应的平均速率v= ______ .

(3) 能说明该反应已经达到平衡状态的是 ______ .
a.NO、O2、NO2的浓度不变
b.v(NO)=2v(O2)
c.NO、O2、NO2的分子数之比为2:1:2
d.v逆(NO2)=2v正(O2)
(4)能使该反应的反应速率增大的是 ______ .
a.适当升高温度b.及时分离出NO2气体
c.增大O2的浓度 d.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HA的酸性弱于HB的酸性。25℃时,用NaOH固体分别改变物质的量浓度均为0.1 molL-1的HA溶液和HB溶液的pH(溶液的体积变化忽略不计),溶液中A-、B-的 物质的量浓度的负对数与溶液的pH的变化悄况如图所示。

下列说法正确的是( )
A. 曲线Ⅰ表示溶液的pH与-lgc(A-)的变化关系
B. ![]()
C. 溶液中水的电离程度:M>N
D. N点对应的溶液中c(Na+)>Q点对应的溶液中c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中各离子浓度关系正确的是
A. pH=2的醋酸溶液与pH=12的氢氧化钠溶液等体积混合:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B. 浓度为0.1 mol·L-1的碳酸氢钠溶液:c(Na+)+ c(H+)=c(HCO3-)+c(OH-)
C. 浓度为0.1 mol·L-1的(NH4)2CO3溶液:c(NH4+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
D. 浓度均为0.1 mol·L-1的醋酸溶液与NaOH溶液混合后:c(OH-)=c(H+)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示某化学反应过程中,生成物的量与时间的关系,图中a、b、c三条曲线不能反映下列哪种因素对生成物的量的影响( )

A. 不同的温度 B. 不同的pH值
C. 不同的底物浓度 D. 不同的酶浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①在BF3分子中,F—B—F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,BF![]() 的立体构型为________;
的立体构型为________;
②在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________。
(2)①Y2X2(C2H2)分子中Y原子轨道的杂化类型为______,1 mol Y2X2含有σ键的数目为______。
②元素Y(C)的一种氧化物与元素Z(N)的一种氧化物互为等电子体,元素Z的这种氧化物的分子式为________。
③化合物ZX3(NH3)的沸点比化合物YX4(CH4)的高,其主要原因是______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com