
(��15��)���������������ҩ�Ϳ�ϵ�����Ӧ�ù㷺��
��1�����й��ڻ�����I��˵������ȷ����
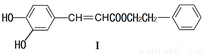
A�����ܷ���������Ӧ��������Ӧ
B��1mol������I�����2molNaOH��Ӧ
C����FeCl3��Һ������ɫ
D�������巢��ȡ���ͼӳɷ�Ӧ
��2�����淴Ӧ��һ����ϩ��ֱ���Ʊ������������·���
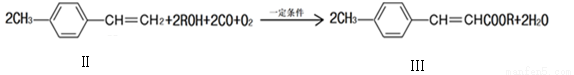
�ٻ�����II�ķ���ʽΪ ��
��1mol������II���� molH2ǡ�÷�Ӧ���ɱ���������
�ۻ��������������NaOH��Һ���ȵĻ�ѧ����ʽΪ ����Ӧ���ͣ�
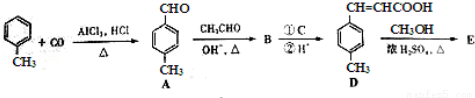
��3��3���Լױ���ϩ�������E����һ�����ںϳɿ�Ѫ˨ҩ���м��壬��ϳ�·�����£�
��֪��HCHO+CH3CHO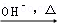 CH2=CHCHO+H2O
CH2=CHCHO+H2O
��A�й����ŵ�����Ϊ ��D�к��������ŵ�����Ϊ ��
��E�Ľṹ��ʽΪ ��
���Լ�C��ѡ�������е�
a����ˮ b��������Һ
c������KMnO4��Һ d������Cu��OH��2����Һ
��B��һ�������¿������ɸ߾���F���÷�Ӧ�Ļ�ѧ����ʽΪ _________ ��
 ��ĩ��ϰ���ϵ�д�
��ĩ��ϰ���ϵ�д� ����ѧ�䵥Ԫ������ĩר����100��ϵ�д�
����ѧ�䵥Ԫ������ĩר����100��ϵ�д� �Ƹ�360�ȶ����ܾ�ϵ�д�
�Ƹ�360�ȶ����ܾ�ϵ�д� ���⿼����Ԫ���Ծ�ϵ�д�
���⿼����Ԫ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꽭��ʡ��ͨ�����ݡ����Ƹ۸����ڶ��ε��в��Ի�ѧ�Ծ��������棩 ���ͣ�ʵ����
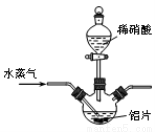
��12�֣�������[Al(NO3)3]��һ�ֳ���ýȾ������ҵ�������ң���Ҫ��Al��Al2O3��Fe2O3�ȣ���ȡ����������[Al(NO3)3��9H2O]���������£�

��1��д����Ӧ������ӷ���ʽ�� ����дһ������
��2������ʵ��������ɷ�Ӧ��Ϊ����������ʧ����Ҫ����������� ���ɲ�ȡ�Ĵ�ʩΪ ��
��3�����������в��ü�ѹ�����������Ʒ�Ӧ���м����ϡ�����Թ�������Ŀ���� ��
��4���¶ȸ���200��ʱ����������ȫ�ֽ�����������������壨�������Ϊ4:1�����÷�Ӧ�Ļ�ѧ����ʽ�� ��
��5��������ͼ��ʾʵ��װ����ȡAl(NO3)3��ͨ��ˮ������������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ�����и������µ��п������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ѧ��Ƽ�����ᡢ����������أ�����˵������ȷ����
A����ȩ��ˮ��Һ����ɱ�������������ã������ڱ��涯��걾
B�����ع��͡���ֹʳ�ã������������Ʒ������������
C������������ʳƷʱʹ�ý϶������������ƣ���ʹʳƷ�ϳ�ʱ�䱣�ֺ���
D�����˻��в��õ���������Ƴ̳����Խ���PM2.5���ŷţ���С������Ⱦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������ʡ��ҵ����ϰͳһ������ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
��15�֣�������㷺����ҽҩ��ʳƷ��Ⱦ�ϡ�����������������ʵ�����Ʊ��������һ�ַ�����
��Ӧԭ����
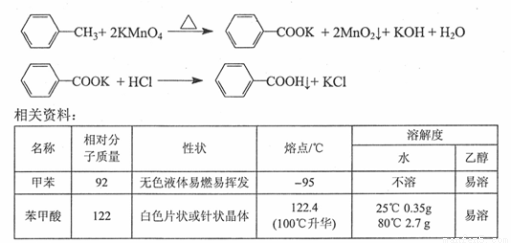
ʵ�鲽�裺
����ͼ��װ��Ӧװ�ã�����ˮ���гּ�����װ��δ������������������ƿ�����μ���120mLˮ��9.4g������غ�3.0mL�ױ���
�ڽ�������ƿ�еĻ��Һ����衢���������ڣ�ֱ���ױ���ȫ��Ӧ��
�۳��ȹ��˷�Ӧ��������Һ����ɫ���������������������������Һ����ɫ��ȥ���ٹ��ˣ�����ˮϴ��������ϴ��Һ�ϲ�����Һ�С�
���ñ�ˮ��ȴ��Һ��Ȼ����Ũ�����ữ�����ˣ���������ˮϴ���������õ�������ֲ�Ʒ�����ؽᾧ�õ����Ƶı����ᡣ
�ش��������⣺
��1��������ƿ��ʢҺ�����ͨ��ռ���ݻ���1/3--2/3����ʵ��Ӧѡ���������ƿ���Ϊ ������ĸ��ţ���
A��100 mL B��250 mL C��500 mL D��1000 mL
��2���жϼױ�����ȫ��Ӧ�������� ������Һ���ٳ������顣
��3��ʵ�鲽����У���������ˮ��������ˮϴ��������Ŀ���� ��������ֲ�Ʒ���˿����ؽᾧ�������⣬������ ����
��4��д�����Ը��������Һ�����������Ʒ�Ӧ���ɺ�ɫ���������ӷ���ʽ ��
��5�����Ƶı����ᴿ�Ȳⶨ����ȡ1.220g��Ʒ����ϡ�Ҵ��ܽⲢ���100 mL��Һ���ֱ�ȡ25.00mL��Һ����0.1000 mo1��L��1NaOH����Һ�ζ������εζ�����NaOH��Һ������ֱ�ΪV1=24.70mL��V2=24.80 mL��V3= 25.80mL��
��������Һʱ��ϡ�Ҵ�����������ˮ���ܼ���ԭ���� ��
�����÷�̪��ָʾ����ȷ���ζ��յ�������� ��
�۲�Ʒ�Ĵ���Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������ʡ��ҵ����ϰͳһ������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��NAΪ�����ӵ�������ֵ������˵����ȷ����
A��4gNaOH����������������Ϊ2NA
B��22.4LC2H6������ѧ������Ϊ7 NA
C�����³�ѹ�£�14gCO��N2�������������������ΪNA
D��0.1 mol��1LNH4C1��Һ�У�NH4����Clһ��֮��С��0.2 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���������У����4��������ѧ�Ծ��������棩 ���ͣ�ѡ����
�����й�ʵ��װ�ý��е���Ӧʵ��,�ܴﵽʵ��Ŀ�ĵ���
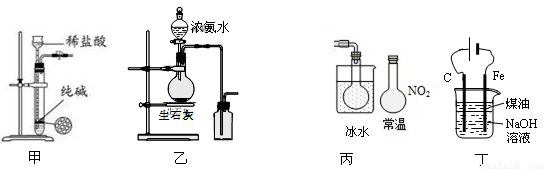
A����ͼ����ʾװ�ÿ�����ȡ����������CO2����
B����ͼ����ʾװ����ȡ���ռ�����
C����ͼ����ʾװ�ÿ���˵����Ӧ2NO2��g�� N2O4��g���Ƿ��ȷ�Ӧ
N2O4��g���Ƿ��ȷ�Ӧ
D����ͼ����ʾװ�ÿ��Ʊ�Fe(OH)2���ܽϳ�ʱ��۲�����ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������к�����������ѧ���ܸ�ϰ�������飨������ѧ�Ծ��������棩 ���ͣ�ѡ����
����20 mL 0.01 mol��L-l HNO2�����ᣩ��Һ����μ���һ��Ũ�ȵ��ռ���Һ����û����Һ���¶ȱ仯����ͼ��ʾ�������й�˵������ȷ����
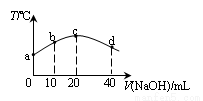
A��HNO2�ĵ���ƽ�ⳣ����c��>b��
B��b������Һ�����ԣ�c(Na+)> c(NO2��) > c(H+)> c(OH��)
C��c������Һ�У�c(OH��) > c(HNO2)
D��d������Һ�У�c(Na+)> c(OH��) >c(NO2��)> c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���Ĵ�ʡ������ѧ�ڵڶ����¿���ѧ�Ծ��������棩 ���ͣ������
��16�֣���Ԫ���ж��ֻ��ϼۣ����γɶ��ֻ����
��1����������1 molL��1 100 mL NaOH��Һǡ����ȫ����0.1 mol SO2���壬�˷�Ӧ�����ӷ���ʽΪ ������ҺpH<7��ԭ���� ����Ϸ���ʽ�ش𣩡���ʯī���缫���������ʵı�����Һʱ��ֻ��һ���缫�������壬д�������ĵ缫��Ӧʽ ��
��2���밴��Ũ���ɴ�С��˳������0.1mol/LNa2SO3��Һ�е����� ��Na2SO3��Һ�����ڿ�����һ��ʱ�����Һ��pH ���������С���� �����䡱����
��3��ijͬѧ�ڳ������������ʵ������̽��Na2S2O3�Ļ�ѧ���ʡ�
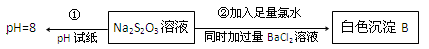
ʵ��ٿ�˵�� ������ĸ��
A����Na2S2O3��Һ��ˮ�����c��OH����=10��8mol/L
B��H2S2O3��һ������
C��Na2S2O3��һ���������
D��Na2S2O3ˮ�ⷽ��ʽΪS2O32��+2H2O H2S2O3+2OH��
H2S2O3+2OH��
д��ʵ��ڷ�����Ӧ�����ӷ���ʽ ��
��4��ʵ�����Ƶõ�Na2S2O3�־��������������������ʡ�Ϊ�˲ⶨ�ֲ�Ʒ��Na2S2O3��5H2O�ĺ�����һ�������������������KMnO4��Һ�ζ��ķ������ٶ��ֲ�Ʒ������������KMnO4��Һ����Ӧ����
��ȡ1.28 g�Ĵ���Ʒ����ˮ����0.40 mol/L KMnO4��Һ���������������ữ���ζ�������Һ��S2O32��ȫ��������ʱ������KMnO4��Һ���20.00 mL��
5S2O32��+8MnO4��+14H+ ��8Mn2++10SO42��+7H2O�����Իش�
�ٴ˵ζ�ʵ���Ƿ���Ҫָʾ�� ����ǡ�����KMnO4��Һ���� �����ʽ����ʽ�����ζ����С�
�����ζ�ʱ����֣��տ�����Һ�ֲ���ɫ��ֹͣ�ζ������ʹ��Ʒ��Na2S2O3��5H2O�����������IJ������ ���ƫ�ߡ���ƫ�͡����䡱����
�۲�Ʒ��Na2S2O3��5H2O����������Ϊ ����Na2S2O3��5H2Oʽ����248��������С�������λ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���Ϻ���������������ѧ���������п��ԣ���ģ����ѧ�Ծ��������棩 ���ͣ�ѡ����
������и�������ʹ֮��ַ�Ӧ,�����û�����������,����300����������������Ϊֹ,���ղ�������Ϊ���������
A����CuSO4��Һ�м����������� B����Ũ�ȵ������(NH4)2SO4��BaCl2
C�������ʵ�����NaHCO3��Na2O2 D����NaBr��Һ��ͨ�������Cl2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com