
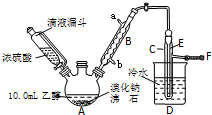
 实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):
实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红色液体 |
| 密度/(g•cm-3) | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
分析 (1)液体加热加入沸石,可以防止液体瀑沸,B为球形冷凝管,应采取逆流原理通入冷凝水,进行充分冷凝回流;
(2)滴液漏斗可以使漏斗的上方和下方的压强相等,使浓磷酸顺利流下;
(3)氢溴酸具有还原性,能被浓硫酸氧化,生成溴单质,浓硫酸被还原成二氧化硫;
(4)给A加热可以加快反应速率蒸出溴乙烷;实验中产生的二氧化硫、溴化氢、溴等可以用稀NaOH溶液吸收;
(5)通过E的末端插入水面以下冷却减少溴乙烷的挥发;
(6)①两种互不相容的液体分离用分液,化学反应的条件温度在常温之上,100℃以下采用水浴加热;
②10mL乙醇的质量为0.79×10g=7.9g,其物质的量为0.172mol,所以理论制得溴乙烷的物质的量为0.172mol,其质量为18.75g,根据产率=$\frac{实际产量}{理论产量}$×100%计算.
解答 解:(1)液体加热加入沸石,可以防止液体瀑沸,B为球形冷凝管,应采取逆流原理通入冷凝水,进行充分冷凝回流,所以B中进水口为b,
故答案为:防止液体瀑沸;b;
(2)滴液漏斗可以使漏斗的上方和下方的压强相等,使浓磷酸顺利流下,而分液漏斗没有这个功能,
故答案为:平衡压强,使浓磷酸顺利流下;
(3)氢溴酸具有还原性,能被浓硫酸氧化,生成溴单质,浓硫酸被还原成二氧化硫,反应的方程式为2HBr+H2SO4(浓)=Br2+SO2↑+2H2O,所以不能用浓H2SO4代替浓磷酸,
故答案为:2HBr+H2SO4(浓)=Br2+SO2↑+2H2O;
(4)加热的目的是加快反应速率,温度高于38.4℃溴乙烷全部挥发蒸馏出来,实验中产生的二氧化硫、溴化氢、溴等会污染空气,所以可以用稀NaOH溶液吸收;
故答案为:加快反应速率,蒸馏出溴乙烷;SO2;防止空气污染;
(5)导管E的末端须在水面以下,通过冷却得到溴乙烷,减少溴乙烷的挥发;
故答案为:冷却并减少溴乙烷的挥发;
(6)①两种互不相容的液体分离用分液,化学反应的条件温度在常温之上,100℃以下采用水浴加热;
故答案为:分液;水浴加热;
②10mL乙醇的质量为0.79×10g=7.9g,其物质的量为0.172mol,所以理论制得溴乙烷的物质的量为0.172mol,其质量为18.75g,所以溴乙烷的产率=$\frac{9.3g}{18.75g}$×100%=49.7%,
故答案为:49.7%.
点评 本题考查有机物制备实验,涉及实验室HBr的制备、物质的分离提纯、对操作与原理的分析评价等,综合考查学生实验分析的能力、知识迁移运用能力,题目难度中等.


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 熔点/℃ | 沸点/℃ | |
| 1-丁醇 | -89.53 | 117.25 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
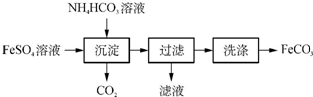
| 实验步骤 | 实验操作步骤 |
| Ⅰ | 取一定质量的FeCO3固体置于坩埚中,高温煅烧至质量不再减轻,冷却至室温 |
| Ⅱ | 取少量实验步骤Ⅰ所得固体置于一洁净的试管中,用足量的稀硫酸溶解 |
| Ⅲ | 向实验步骤Ⅱ所得溶液中滴加KSCN溶液,溶液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(待测液)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.00 | 0.200 | 0.10 | 0.00 |
| V(NaOH)/mL(终读数) | 14.95 | 15.20 | 15.15 | 16.95 |
| V(NaOH)/mL(消耗) | 14.95 | 15.00 | 15.05 | 16.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
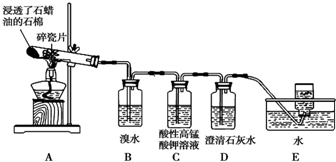
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室中用标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室中用标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲组同学拟用高锰酸钾制取氧气,并收集和测量氧气体积,其装置如图所示.
甲组同学拟用高锰酸钾制取氧气,并收集和测量氧气体积,其装置如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com