
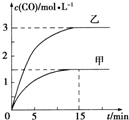
 T℃下发生反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、乙两个恒容密闭容器中加入一定量C和H2O,各容器的容积、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示:下列说法正确的是( )
T℃下发生反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、乙两个恒容密闭容器中加入一定量C和H2O,各容器的容积、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示:下列说法正确的是( )| 容器 | 甲 | 乙 |
| 容积 | 0.5L | V |
| 2molC 1molH2O | 4molC 2molH2O |
| A、甲容器中前15min反应的平均速率υ(H2)=0.2 mol?L-1?min-1 |
| B、乙容器的容积V=0.5 L |
| C、向甲容器加入少量C(s),平衡正向移动 |
| D、反应温度升高,平衡常数增大 |
| △c |
| △t |
| 1.5mol/L |
| 15min |


科目:高中化学 来源: 题型:
| A、制作快餐饭盒的可降解“玉米塑料”(主要成分是聚乳酸)是纯净物 |
| B、“天宫一号”使用的碳纤维,是一种新型有机高分子材料 |
| C、福尔马林可作食品的保鲜剂 |
| D、用CO2合成聚碳酸酯可降解塑料,实现碳的循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某烃A 0.2mol在氧气中充分燃烧后,生成化合物B、C各1.2mol,试回答下列问题:
某烃A 0.2mol在氧气中充分燃烧后,生成化合物B、C各1.2mol,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单质硫在空气中燃烧可生成SO2 |
| B、SO2能使品红溶液褪色是因为它具漂白性,加热可恢复原本红色 |
| C、SO2和Cl2都具有漂白作用,所以将两种气体等物质的量同时作用于潮湿有色物,可增强漂白作用 |
| D、SO2能使加酚酞的NaOH溶液褪色是因为它能与NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(NH4+)相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c(NH4Cl) |
| B、向AgCl悬浊液中滴入KI溶液有AgI沉淀生成,说明AgCl的溶解度小于AgI的溶解度 |
| C、0.2 mol/L HCl溶液与等体积0.05 mol/L Ba(OH)2 溶液混合后,溶液的pH=1 |
| D、0.2 mol/L的NaHCO3溶液中c(H-)+c(Na+)=c(CO32-)+c(OH-)+c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素R位于周期表中第ⅤA族 |
| B、RO3-中的R只能被还原 |
| C、R2在常温常压下一定是气体 |
| D、若1 mol RO3-参与该反应,则转移的电子的物质的量为5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 阳离子半径/pm | 66 | 99 | 112 | 135 |
| A、离子晶体中阳离子的半径越大,越易分解 |
| B、离子晶体中阳离子的半径越小,越易分解 |
| C、离子晶体中阳离子的半径越大,结合碳酸根中的氧离子越容易 |
| D、离子晶体中阳离子的半径越小,结合碳酸根中的氧离子越容易 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol?L-1 |
| B、醋酸浓度为硫酸浓度的2倍 |
| C、醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等 |
| D、分别加入足量锌片,两种溶液生成H2的体积相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com