
| A. | 氨气分子的电子式: | B. | 硫原子结构示意图: | ||
| C. | KCl的电子式: | D. | H2O2的电子式: |
分析 A.氨气分子中N原子最外层满足8电子稳定结构;
B.硫原子的核电荷数=核外电子总数=16,最外层含有6个电子;
C.氯化钾为离子化合物,阴阳离子都需要标出所带电荷,氯离子还需要标出最外层电子;
D.双氧水为共价化合物,分子中不存在阴阳离子.
解答 解:A.氨气分子中含有3个N-H键,N原子最外层达到8电子稳定结构,氨气正确的电子式为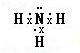 ,故A错误;
,故A错误;
B.硫原子核外存在16个电子核内有16个质子,其离子结构示意图为: ,故B错误;
,故B错误;
C.KCl为离子化合物,钾离子直接用离子符号表示,氯离子需要标出所带电荷及最外层电子,氯化钾的电子式为 ,故C正确;
,故C正确;
D.双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为 ,故D错误;
,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及电子式、原子结构示意图与离子结构示意图等知识,明确常见化学用语的书写原则为解答关键,试题有利于提高学生的规范答题能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 其数目分别用a、b、c、d表示,对烷烃(除甲烷外)中存在的关系作讨论:
其数目分别用a、b、c、d表示,对烷烃(除甲烷外)中存在的关系作讨论:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
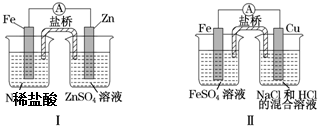
| A. | 装置Ⅰ中铁溶解、锌不溶解,装置Ⅱ中铁溶解、铜不溶解 | |
| B. | 装置Ⅰ中电流表指针不偏转,装置Ⅱ中电流表指针偏转 | |
| C. | 装置Ⅰ和装置Ⅱ中正极反应均是2H++2e-═2H2 | |
| D. | 盐桥中的阳离子均向右侧烧杯移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
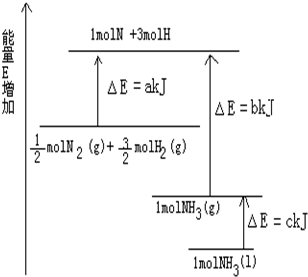 已知化学反应N2+3H2═2NH3的能量变化如图所示,
已知化学反应N2+3H2═2NH3的能量变化如图所示,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2 CH2CH3和CH3CH(CH3)2 | B. | CH2=C(CH3)2和CH3CH=CHCH3 | ||
| C. | CH3CH2OH和CH3OCH3 | D. | CH3CH2COOH 和CH3COOCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 48 | B. | 80 | C. | 128 | D. | 208 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com