

| 温度 | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
分析 (1)反应中I2→KH(IO3)2,I元素化合价由0价升高为+5价,共升高10价.KClO3→KCl、Cl2,氯元素化合价降低,还原产物为KCl、Cl2,KClO3→KCl氯元素化合价由+5降低为-1价,化合价降低6价,KClO3→Cl2氯元素化合价由+5降低为0价,化合价总共降低10价,二者获得的电子数目相同,获得电子最小公倍数为30,则KCl的系数为5,Cl2的系数为3,所以化合价降低60价,故I2系数为6,根据元素守恒配平KClO3、H2O、KH(IO3)2的系数;
(2)酸性条件下碘酸钾是一种较强的氧化剂,HI具有还原性;
(3)由题中信息可知,在碱性条件下碘酸钾能被氯气氧化为高碘酸钾;
(4)过滤用的玻璃仪器有漏斗、玻璃棒、烧杯等;
(5)调节溶液pH,可加入KOH或K2CO3,以防止引入新杂质;
(6)由表中数据可知KIO3在常温下的溶解度较小,且KIO3在650℃分解,据此判断得到碘酸钾晶体的方法.
解答 解:(1)反应中I2→KH(IO3)2,I元素化合价由0价升高为+5价,共升高10价.KClO3→KCl、Cl2,氯元素化合价降低,还原产物为KCl、Cl2,KClO3→KCl氯元素化合价由+5降低为-1价,化合价降低6价,KClO3→Cl2氯元素化合价由+5降低为0价,化合价总共降低10价,二者获得的电子数目相同,获得电子最小公倍数为30,则KCl的系数为5,Cl2的系数为3,所以化合价降低共60价,故I2系数为6,根据氯元素守恒可知KClO3系数为11,根据碘元素守恒可知KH(IO3)2的系数为6,根据氢元素守恒可知H2O、系数为3,检查氧元素守恒,故方程式为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑,
故答案为:6,11,3,6,5,3;
(2)步骤中产生氯气,需要将氯气排出反应体系,加入硝酸的目的是制造酸性环境,促进氯气从反应体系中逸出,酸性条件下碘酸钾是一种较强的氧化剂,HI具有还原性,能将已生成的碘酸氢钾还原,
故答案为:HI具有还原性能将已生成的碘酸氢钾还原;
(3)由题中信息可知,在碱性条件下碘酸钾能被氯气氧化为高碘酸钾,所以应将氯气排出,
故答案为:反应产生氯气跟KOH反应生成KClO,KClO能将KIO3氧化成KIO4,从而不能得到KIO3;
(4)过滤用的玻璃仪器有漏斗、玻璃棒、烧杯等,
故答案为:漏斗、玻璃棒、烧杯;
(5)调节溶液pH,可加入KOH,以防止引入新杂质,反应的方程式为KH(IO3)2+KOH=KIO3+H2O,
故答案为:KH(IO3)2+KOH=KIO3+H2O;
(6)由表中数据可知KIO3在常温下的溶解度较小,又KIO3在650℃即分解,故最好采用蒸发浓缩溶液,让KIO3结晶析出再行过滤分离的方法,
故答案为:蒸发结晶.
点评 本题以工业生产碘酸钾为载体,为高频考点,侧重于学生的分析能力、实验能力和计算能力的考查,内容涉及方程式配平、对工艺流程的理解评价、方案设计等,难度中等,是对知识的综合运用和能力的考查.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 再通入少量氯气,$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 | |
| B. | 光照一段时间氯水,溶液的pH值增大 | |
| C. | 加入少量固体AgNO3,溶液的pH值减小 | |
| D. | 加入少量水,水的电离平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1>△H2 | B. | a=b | C. | a>b | D. | a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4m mol | B. | 10m mol | C. | $\frac{10m}{3}$mol | D. | $\frac{2m}{3}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
| 原料生产工艺过程 | |
| 乙炔 | CaCO3$\stackrel{①850-1100℃}{→}$CaO$→_{1100℃}^{②+C、电炉}$CaC2$\stackrel{③饱和食盐水}{→}$C2H2 |
| 乙烯 | 来源于石油裂解气 |
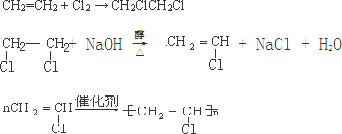 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

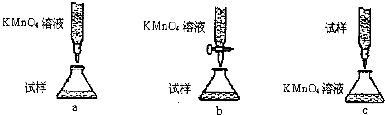
| 序号 | 操作 | 可能出现的现象 | 结论 |
| ① | 向a试管中滴加几滴0.01mol/L的KMnO4 | 若溶液褪色 | 则假设1成立 |
| 若溶液不褪色 | 则假设2或3成立 | ||
| ② | 向b试管中滴加几滴品红 | 若溶液褪色 | 则假设1或3成立 |
| 若溶液不褪色 | 则假设2成立 | ||
| ③ | 向c试管中滴加几滴淀粉-KI溶液 | 则假设3成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com