
在化学中有很多规律,下列对规律的应用正确的是
A.根据较强酸可制取较弱酸的规律,可向次氯酸钠溶液中通入二氧化碳制取次氯酸
B.根据金属与盐溶液混合发生置换反应的规律,可用钠置换出硫酸铜溶液中的铜
C.根据酸性氧化物不与酸反应的规律,可用二氧化硅制成的容器盛放氢氟酸
D.根据电荷守恒规律,可判断溶液中所含阳离子数目一定等于阴离子数目
科目:高中化学 来源:2015届山东省高三上学期第一次(10月)检测化学试卷(解析版) 题型:选择题
下列关于铝的叙述中正确的是
A.铝合金是一种混合物,它比纯铝的熔点高
B.由于铝的导电性比铜、银都强,所以常用其制造电线、电缆
C.由于铝具有强还原性,所以可以通过铝热反应冶炼某些高熔点金属
D.常温下,由于铝与浓硫酸钝化时不反应,所以可用铝制槽车运送浓硫酸
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三第一次学情调查化学试卷(解析版) 题型:选择题
将Q和R加入到密闭体系中,在一定条件下发生反应3Q(s)+R(g)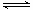 2W(g)。平衡时W的体积分数随温度和压强的变化如下表所示:
2W(g)。平衡时W的体积分数随温度和压强的变化如下表所示:
| 1 MPa | 2 MPa | 3 MPa |
500℃ | 45.3% |
|
|
700℃ | a | 66.7% |
|
900℃ |
|
| 73.6% |
下列说法正确的是
A.该反应的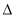 H<0
H<0
B.45.3%<a<66.7%
C.该反应的平衡常数K(900℃)>K(700℃)
D.700℃、2 MPa时R的转化率为50%
查看答案和解析>>
科目:高中化学 来源:2015届山东省文登市高三上学期11月月考化学试卷(B卷)(解析版) 题型:选择题
下列实验操作或装置(略去部分加持仪器)正确的是
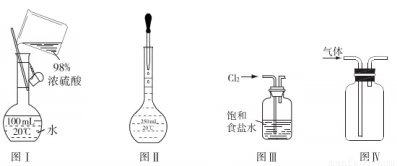
A.图Ⅰ表示为配制一定物质的量浓度稀硫酸时的操作
B.图Ⅱ表示为配制一定物质的量浓度的溶液定容时的操作
C.用图Ⅲ所示装置吸收氯气中的氯化氢气体
D.用图Ⅳ所示装置收集一氧化氮气体
查看答案和解析>>
科目:高中化学 来源:2015届山东省文登市高三上学期11月月考化学试卷(A卷)(解析版) 题型:实验题
(18分)按要求回答下列问题
(1)某小组同学探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
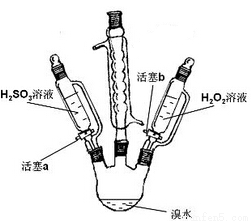
①打开活塞a,逐滴加入H2SO3溶液到过量,烧瓶内溶液变为无色,该反应的离子方程式为________,得出的结论是:H2SO3的氧化性比Br2的氧化性______(填“强”或“弱”)。
②再打开活塞b,向所得溶液中逐滴加入H2O2,刚开始溶液颜色无明显变化,继续滴加,溶液变为橙黄色,变橙黄色反应的离子方程式为_____________________________,得出的结论是H2O2的氧化性比Br2的氧化性____(填“强”或“弱”)。
(2)某学习小组向盛有氯化钡溶液的试管中通入二氧化硫气体,发现有白色沉淀,为了清楚沉淀的物质,研究小组向试管中加入过量稀盐酸,沉淀不溶解,你认为沉淀物是____________,产生该物质可能的原因是________________________。
(3)为探究SO2使品红溶液褪色的原因,该小组同学将干燥的SO2气体通入品红的四氯化碳溶液中,发现品红不褪色,由此所得出的结论正确的是__________(填编号)。
a.SO2使品红溶液褪色的微粒一定不是SO2分子
b.SO2使品红溶液褪色的微粒一定是H2SO3分子
c.此实验无法确定SO2使品红溶液褪色的微粒
d.将干燥的SO2气体通入品红的酒精溶液中,能使品红褪色由此可猜想使品红溶液褪色的微粒可能是___________________________。
(4)配平并完成下列离子方程式___MnO4-+___H2O2+___ ____=__Mn2++__O2+__H2O每有1mol高锰酸根参加反应,生成_______mol O2。
查看答案和解析>>
科目:高中化学 来源:2015届山东省德州市高三期中考试化学试卷(解析版) 题型:选择题
下列各图所示装置的气密性检查中,漏气的是
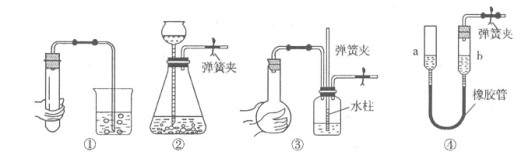
A.对装置①,双手移去后,导管中水面高于烧杯内水面
B.对装置②,长颈漏斗内液面高度保持不变
C.对装置③,长导管内形成一段水柱
D.对装置④,上下移动a管后,a、b两端液面仍相平
查看答案和解析>>
科目:高中化学 来源:2015届山东省德州市高三10月月考化学试卷(解析版) 题型:填空题
(14分)某实验小组配制0.10mol/L NaOH溶液并进行有关性质实验,回答下列问题。
(1)若实验中大约要使用475mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母) 。
名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 | | | | | | |
序号 | a | b | c | d | e | f |
(3)下列情况会使所配溶液浓度偏低的是(填序号)
①称量时,左盘高,右盘低
②固体溶解后未冷却到室温就直接转移到容量瓶中
③溶液转移到容量瓶后,未进行洗涤操作
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
(4)向VmL上述浓度的NaOH溶液中,通入一定量的CO2后,然后向该溶液中逐滴加入1mol L-1的盐酸,所加入盐酸溶液的体积与产生CO2的体积关系如下图所示:
L-1的盐酸,所加入盐酸溶液的体积与产生CO2的体积关系如下图所示:
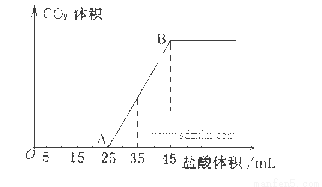
①当加入35.0mL盐酸溶液时,产生标准状况下二氧化碳的体积为__________mL;
②计算所取氢氧化钠溶液的体积V=__________mL。
(5)取上述氢氧化钠溶液200mL,加入适量铝粉使之恰好完全反应,该反应的化学方程式为__________________________________,逐渐向反应后的溶液中至少加入1.0 mol L-1的盐酸________ mL才能使生成的沉淀完全溶解。
L-1的盐酸________ mL才能使生成的沉淀完全溶解。
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三11月阶段模块考试化学试卷(解析版) 题型:实验题
(10分)某氯化铁样品含有FeCl2杂质.现要测定其中铁元素的质量分数,实验按以下步骤进行:
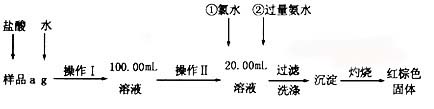
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 (填仪器名称).
(2)加入过量氨水生成沉淀的离子方程式为 ;
(3)若不用氯水,可用下列试剂中的 代替(填序号)。
A.H2O2 B.碘水 C.NaClO
(4)步骤⑤中检验沉淀是否洗净的方法是 。
(5)若坩埚质量为W1g,坩埚及灼烧后的固体总质量为W2g,样品中铁元素的质量分数为
(请把结果约到最简)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com