
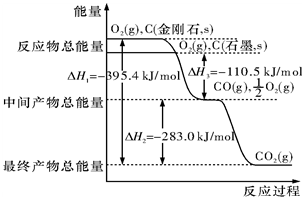
 金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示.
金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示.分析 (1)依据物质能量越高,物质越不稳定;依据图象判断石墨的燃烧热;
(2)依据极值计算判断生成的气体组成,结合热化学方程式计算得到.
解答 解:(1)图象分析金刚石能量高于石墨,能量越低越稳定,所以说明石墨稳定,图象分析1mol石墨完全燃烧生成1mol二氧化碳放出的热量为393.5kJ,则石墨的燃烧热为393.5kJ?mol-1;
故答案为:石墨;393.5kJ?mol-1;
(2)12g石墨物质的量为1mol,在一定量空气中燃烧,依据元素守恒,若生成二氧化碳质量为44g,若生成一氧化碳质量为28g,生成气体36g,28g<36g<44g,判断生成的气体为一氧化碳和二氧化碳气体,设一氧化碳物质的量为x,二氧化碳物质的量为(1-x)mol,28x+44(1-x)=36g,x=0.5mol,二氧化碳物质的量为0.5mol;依据图象分析,C(石墨,s)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1 ;C(石墨,s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5 kJ•mol-1
生成二氧化碳和一氧化碳混合气体放出热量=393.5 kJ•mol-1 ×0.5mol+110.5 kJ•mol-1 ×0.5mol=252KJ;12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量为252.0kJ;
故答案为:252.0 kJ.
点评 本题考查了化学反应与能量、盖斯定律、物质稳定性的判断,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度中等,注意把握盖斯定律的含义及其应用方法.


科目:高中化学 来源: 题型:选择题
| A. | 原子半径 A>B>D>C | B. | 原子序数 D>C>B>A | ||
| C. | 离子半径 C3->D->B+>A2+ | D. | 单质的还原性 A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铜与稀盐酸反应 O2-+2H+═H2O | |
| B. | 向碳酸氢钠溶液中滴加稀盐酸:HCO3-+H+═H2O+CO2↑ | |
| C. | 氢氧化钡溶液和稀硫酸反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 向澄清石灰水中通入少量CO2:CO2+OH-═HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HSO3与足量的2 mol/L硫酸溶液混合微热,产生的刺激性气味的气体是NH3 | |
| B. | 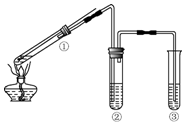 用如图所示装置探究铜丝与过量浓硫酸的反应,为确认CuSO4生成,向①中加水,观察颜色 | |
| C. | 取适量铁粉与一定量的稀硝酸恰好完全反应,体现酸性的硝酸与体现氧化性的硝酸的物质的量之比为3:1 | |
| D. | 电解熔融氯化铝制备金属铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用I2O5可消除CO污染或定量测定CO,反应为:
利用I2O5可消除CO污染或定量测定CO,反应为:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (写结构简式).
(写结构简式).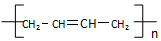 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将58.5 g NaCl溶解于1 L 水中 | |
| B. | 将22.4 L氨气溶于水配成1 L溶液 | |
| C. | 将1 L 10 mol•L-1的浓盐酸与9 L水混合 | |
| D. | 将10 g NaOH溶解在水中配成250 mL溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com