
“ÓÄÜĮæµÄ±ä»ÆŗĶ·“Ó¦µÄæģĀżµČ½Ē¶ČŃŠ¾æ·“Ó¦£ŗ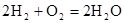 ”£
ӣ
£Ø1£©ĪŖĮĖ¼ÓæģÕż·“Ó¦ĖŁĀŹ£¬æÉŅŌ²ÉČ”µÄ“ėŹ©ÓŠ________£ØĢīŠņŗÅ£¬ĻĀĶ¬£©”£
| A£®Ź¹ÓĆ“ß»Æ¼Į | B£®ŹŹµ±ĢįøßŃõĘųµÄÅØ¶Č |
| C£®ŹŹµ±Ģįøß·“Ó¦µÄĪĀ¶Č | D£®ŹŹµ±½µµĶ·“Ó¦µÄĪĀ¶Č |
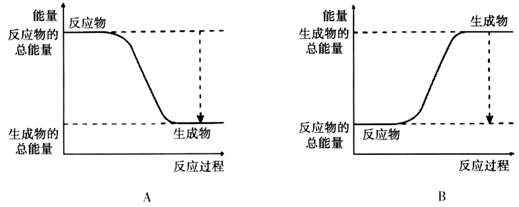
| »Æѧ¼ü | H”ŖH | O£½O | H”ŖO |
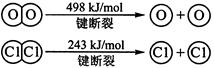
¼üÄÜ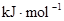 | 436 | 496 | 463 |
| »Æѧ¼ü | Ģī”°ĪüŹÕČČĮæ”± »ņ”°·Å³öČČĮæ”± | ÄÜĮæ±ä»Æ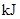 | |
| ²šæŖ»Æѧ¼ü | 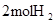 ÖŠµÄ»Æѧ¼ü ÖŠµÄ»Æѧ¼ü | _______________ | _______________ |
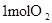 ÖŠµÄ»Æѧ¼ü ÖŠµÄ»Æѧ¼ü | |||
| ŠĪ³É»Æѧ¼ü | 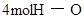 ¼ü ¼ü | _______________ | _______________ |
| ×ÜÄÜĮæ±ä»Æ | _______________ | _______________ | |
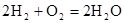 ”£ĘäÖŠ£¬ĒāĘųŌŚ________£ØĢī”°Õż”±»ņ”°øŗ”±£©¼«·¢Éś________·“Ó¦£ØĢī”°Ńõ»Æ”±»ņ”°»¹Ō”±£©”£µēĀ·ÖŠĆæ×ŖŅĘ0£®2molµē×Ó£¬±ź×¼×“æöĻĀĻūŗÄH2µÄĢå»żŹĒ________L”£
”£ĘäÖŠ£¬ĒāĘųŌŚ________£ØĢī”°Õż”±»ņ”°øŗ”±£©¼«·¢Éś________·“Ó¦£ØĢī”°Ńõ»Æ”±»ņ”°»¹Ō”±£©”£µēĀ·ÖŠĆæ×ŖŅĘ0£®2molµē×Ó£¬±ź×¼×“æöĻĀĻūŗÄH2µÄĢå»żŹĒ________L”£ £Ø1£©ABC £Ø2£©A
£Ø3£©»Æѧ¼ü Ģī”°ĪüŹÕ”±»ņ”°·Å³ö”±ÄÜĮæ ÄÜĮæ±ä»Æ£ØkJ£© ²šæŖ»Æѧ¼ü 2molH2ÖŠµÄ»Æѧ¼ü ĪüŹÕČČĮæ 1368 1molO2ÖŠµÄ»Æѧ¼ü ŠĪ³É»Æѧ¼ü 4molH-O¼ü ·Å³öČČĮæ 1852 ×ÜÄÜĮæ±ä»Æ ·Å³öČČĮæ 484
£Ø4£©øŗ Ńõ»Æ 2£®24
½āĪöŹŌĢā·ÖĪö£ŗ£Ø1£©A”¢B”¢C¾łĪŖŌö“ó·“Ó¦ĖŁĀŹµÄ·½·Ø£¬DĪŖ¼õŠ”·“Ó¦ĖŁĀŹ”£
£Ø2£©øĆ·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬·“Ó¦ĪļµÄ×ÜÄÜĮæ“óÓŚÉś³ÉĪļµÄ×ÜÄÜĮ攣
£Ø3£©“ņĘĘ2molH2ŠčŅŖĪüŹÕ2mol”Į436KJ/mol=872KJ£»“ņĘĘ1molO2ŠčŅŖĪüŹÕ1mol”Į496KJ/mol=496KJ
Ōņ¹²ŠčŅŖÄÜĮæ872KJ+496KJ=1368KJÄÜĮ棻ŠĪ³É4molH-O¼üÄܹ»·Å³ö4mol”Į463KJ/mol=1852KJ£»¹Ź×ÜÄÜĮæ±ä»ÆĪŖ1852KJ-1368KJ=484KJ”£
£Ø4£©H2ŌŚ·“Ó¦ÖŠŹ§Č„µē×Ó£¬ĪŖøŗ¼«£¬·¢ÉśŃõ»Æ·“Ó¦”£ ŌŚČ¼ĮĻµē³Ų·“Ó¦ÖŠ£¬µ±µēĀ·×ŖŅĘ0£®2molµē×ÓŹ±£¬ĻūŗÄ0£®1molĒāĘų£¬±źæöĻĀ£¬Ģå»żĪŖ2£®24L”£
æ¼µć£ŗÓ°Ļģ»Æѧ·“Ó¦ĖŁĀŹµÄŅņĖŲ£¬»Æѧ·“Ó¦µÄÄÜĮæ±ä»Æ¼ĘĖćŅŌ¼°Č¼ĮĻµē³ŲµÄ»ł±¾ÖŖŹ¶”£


 ¾«Ó¢æŚĖćæØĻµĮŠ“š°ø
¾«Ó¢æŚĖćæØĻµĮŠ“š°ø Ó¦ÓĆĢāµć²¦ĻµĮŠ“š°ø
Ó¦ÓĆĢāµć²¦ĻµĮŠ“š°ø דŌŖ¼°µŚĻµĮŠ“š°ø
דŌŖ¼°µŚĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
I£®ŅŃÖŖ£ŗ·“Ó¦H2(g) + Cl2(g) = 2HCl(g) ¦¤H=" ”Ŗ184" kJ/mol
4HCl(g)+O2(g) 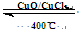 2Cl2(g)+2H2O(g) ¦¤H=" ”Ŗ115.6" kJ/mol
2Cl2(g)+2H2O(g) ¦¤H=" ”Ŗ115.6" kJ/mol 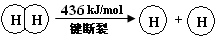
Ēė»Ų“š£ŗ
£Ø1£©H2ÓėO2·“Ӧɜ³ÉĘųĢ¬Ė®µÄČČ»Æѧ·½³ĢŹ½
£Ø2£©¶ĻæŖ1 mol H”ŖO ¼üĖłŠčÄÜĮæŌ¼ĪŖ kJ
II£®ŹŌŌĖÓĆĖłŃ§ÖŖŹ¶£¬½ā¾öĻĀĮŠĪŹĢā£ŗ
£Ø1£©ŅŃÖŖij·“Ó¦µÄĘ½ŗā±ķ“ļŹ½ĪŖ£ŗ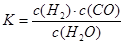 £¬ĖüĖł¶ŌÓ¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ
£¬ĖüĖł¶ŌÓ¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ
£Ø2£©ŅŃÖŖŌŚ400”ꏱ£¬N2 (g)+ 3H2(g)  2NH3(g) ”÷H<0 µÄK=0.5£¬Ōņ400”ꏱ£¬ŌŚ0.5LµÄ·“ӦȯĘ÷ÖŠ½ųŠŠŗĻ³É°±·“Ó¦£¬Ņ»¶ĪŹ±¼äŗ󣬲āµĆN2”¢H2”¢NH3µÄĪļÖŹµÄĮæ·Ö±šĪŖ2mol”¢1mol”¢2mol£¬Ōņ“ĖŹ±·“Ó¦v(N2)Õż v(N2)Äę£ØĢī£ŗ£¾”¢£¼”¢£½”¢²»ÄÜČ·¶Ø£©£Ø1·Ö£©
2NH3(g) ”÷H<0 µÄK=0.5£¬Ōņ400”ꏱ£¬ŌŚ0.5LµÄ·“ӦȯĘ÷ÖŠ½ųŠŠŗĻ³É°±·“Ó¦£¬Ņ»¶ĪŹ±¼äŗ󣬲āµĆN2”¢H2”¢NH3µÄĪļÖŹµÄĮæ·Ö±šĪŖ2mol”¢1mol”¢2mol£¬Ōņ“ĖŹ±·“Ó¦v(N2)Õż v(N2)Äę£ØĢī£ŗ£¾”¢£¼”¢£½”¢²»ÄÜČ·¶Ø£©£Ø1·Ö£©
ÓūŹ¹µĆøĆ·“Ó¦µÄ»Æѧ·“Ó¦ĖŁĀŹ¼Óæģ£¬Ķ¬Ź±Ź¹Ę½ŗāŹ±NH3µÄĢå»ż°Ł·ÖŹżŌö¼Ó£¬æɲÉČ”µÄÕżČ·“ėŹ©ŹĒ £ØĢīŠņŗÅ£©£Ø1·Ö£©
A£®ĖõŠ”Ģå»żŌö“óŃ¹Ēæ B£®ÉżøßĪĀ¶Č C£®¼Ó“߻ƼĮ D£®Ź¹°±ĘųŅŗ»ÆŅĘ×ß
£Ø3£©ŌŚŅ»¶ØĢå»żµÄĆܱÕČŻĘ÷ÖŠ£¬½ųŠŠČēĻĀ»Æѧ·“Ó¦£ŗA(g) + 3B(g)  2C(g) + D£Øs£© ¦¤H£¬Ęä»ÆŃ§Ę½ŗā³£ŹżKÓėĪĀ¶ČtµÄ¹ŲĻµČēĻĀ±ķ£ŗ
2C(g) + D£Øs£© ¦¤H£¬Ęä»ÆŃ§Ę½ŗā³£ŹżKÓėĪĀ¶ČtµÄ¹ŲĻµČēĻĀ±ķ£ŗ
| t/K | 300 | 400 | 500 | ” |
| K/(mol”¤L”Ŗ1)2 | 4”Į106 | 8”Į107 | K1 | ” |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
Ķź³ÉĻĀĮŠČČ»Æѧ·½³ĢŹ½£Ø»Æѧ·½³ĢŹ½”¢µē¼«·“Ó¦Ź½”¢±ķ“ļŹ½µČ£©µÄŹéŠ“£ŗ
£Ø1£©ŅŃÖŖ£ŗ2Cu(s)£«1/2O2(g)=Cu2O(s)£»”÷H=-169kJ”¤mol-1£¬
C(s)£«1/2O2(g)=CO(g)£»”÷H=-110.5kJ”¤mol-1£¬
Cu(s)£«1/2O2(g)=CuO(s)£»”÷H=-157kJ”¤mol-1
ÓĆĢæ·ŪŌŚøßĪĀĢõ¼žĻĀ»¹ŌCuOÉś³ÉCu2OµÄČČ»Æѧ·½³ĢŹ½ŹĒ£ŗ
£Ø2£©ŌŚŅ»¶ØĢõ¼žĻĀ£¬¶žŃõ»ÆĮņŗĶŃõĘų·¢ÉśČēĻĀ·“Ó¦£ŗ2SO2(g)+O2(g) 2SO3(g)£¬Š“³öøĆ·“Ó¦µÄ»ÆŃ§Ę½ŗā³£Źż±ķ“ļŹ½£ŗ
2SO3(g)£¬Š“³öøĆ·“Ó¦µÄ»ÆŃ§Ę½ŗā³£Źż±ķ“ļŹ½£ŗ
£Ø3£©ŅŌ¼×Ķ锢æÕĘųĪŖ·“Ó¦Īļ£¬KOHČÜŅŗ×÷µē½āÖŹČÜŅŗ¹¹³ÉČ¼ĮĻµē³Ų£¬Ōņøŗ¼«·“Ó¦Ź½ĪŖ£ŗ ”£
£Ø4£©ĢśŌŚ³±ŹŖµÄæÕĘųÖŠ·¢ÉśĪüŃõøÆŹ“µÄµē³Ų·“Ó¦·½³ĢŹ½ĪŖ ”£
£Ø5£©”°Ć¾”Ŗ“ĪĀČĖįŃĪ”±Č¼ĮĻµē³Ų£¬Ęä×°ÖĆŹ¾ŅāĶ¼ČēĶ¼£¬øƵē³Ų·“Ó¦µÄ×Ü·“Ó¦·½³ĢŹ½ĪŖ_______________”£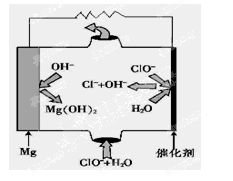
£Ø6£©¹¤ŅµÉĻµē½āČŪČŚĀČ»ÆÄʵķ½³ĢŹ½ĪŖ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
¢ń£ŗ¹¤ŅµÉĻÓĆCO2ŗĶH2ŌŚŅ»¶ØĢõ¼ž·¢ÉśČēĻĀ·“Ó¦ŗĻ³É¼×“¼²¢·Å³ö“óĮæµÄČČ£ŗCO2(g)+3H2(g) CH3OH(g)+H2O(g) ¦¤H1 »Ų“šĻĀĮŠĪŹĢā”£
CH3OH(g)+H2O(g) ¦¤H1 »Ų“šĻĀĮŠĪŹĢā”£
£Ø1£©ŅŃÖŖ£ŗ2H2(g)+O2(g)=2H2O(g) ¦¤H2
Ōņ·“Ó¦2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ¦¤H= £ØÓĆŗ¬¦¤H1”¢¦¤H2±ķŹ¾£©
£Ø2£©Čō·“Ó¦ĪĀ¶ČÉżøߣ¬CO2µÄ×Ŗ»ÆĀŹ (Ģī”°Ōö“ó”±”°¼õŠ””±»ņ”°²»±ä”±£©”£
£Ø3£©Š“³öŌŚĖįŠŌ»·¾³ÖŠ£¬¼×“¼Č¼ĮĻµē³ŲÖŠµÄÕż¼«·“Ó¦·½³ĢŹ½
¢ņ£ŗÉś²ś¼×“¼µÄŌĮĻH2æÉÓĆČēĻĀ·½·ØÖĘµĆ£ŗCH4(g) + H2O(g)  CO(g) + 3H2(g)£¬Ņ»¶ØĪĀ¶ČĻĀ£¬½«2 mol CH4ŗĶ4 mol H2OĶØČėČŻ»żĪŖ10LµÄĆܱշ“Ó¦ŹŅÖŠ£¬·“Ó¦ÖŠCOµÄĪļÖŹµÄĮæÅØ¶ČµÄ±ä»ÆĒéæöČēĶ¼ĖłŹ¾£¬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
CO(g) + 3H2(g)£¬Ņ»¶ØĪĀ¶ČĻĀ£¬½«2 mol CH4ŗĶ4 mol H2OĶØČėČŻ»żĪŖ10LµÄĆܱշ“Ó¦ŹŅÖŠ£¬·“Ó¦ÖŠCOµÄĪļÖŹµÄĮæÅØ¶ČµÄ±ä»ÆĒéæöČēĶ¼ĖłŹ¾£¬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø4£©·“Ó¦½ųŠŠµ½4·ÖÖÓµ½“ļĘ½ŗā”£Ēė¼ĘĖć“Ó·“Ó¦æŖŹ¼µ½øÕøÕĘ½ŗā£¬Ę½¾ł·“Ó¦ĖŁĀŹv(H2)ĪŖ £»²¢Ēó“Ė·“Ó¦ŌŚ“ĖĪĀ¶ČĻĀµÄĘ½ŗā³£Źż£ØŌŚ“šĢāæضŌÓ¦µÄ·½æņÄŚŠ“³ö¼ĘĖć¹ż³Ģ£©”£
£Ø5£©ŌŚµŚ5·ÖÖÓŹ±½«ČŻĘ÷µÄĢå»żĖ²¼äĖõŠ”Ņ»°ėŗó£¬ČōŌŚµŚ8·ÖÖÓŹ±“ļµ½ŠĀµÄĘ½ŗā£Ø“ĖŹ±COµÄÅضČŌ¼ĪŖ0.25 mol”¤L”Ŗ1 £©£¬ĒėŌŚĶ¼ÖŠ»³öµŚ5·ÖÖÓŗóH2ÅØ¶ČµÄ±ä»ÆĒśĻß”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
µŖŹĒµŲĒņÉĻŗ¬Įæ·įø»µÄŅ»ÖÖŌŖĖŲ£¬µŖ¼°Ęä»ÆŗĻĪļŌŚ¹¤ Å©ŅµÉś²ś”¢Éś»īÖŠÓŠ×ÅÖŲŅŖ×÷ÓĆ£¬ 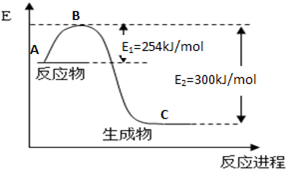
£Ø1£©ÉĻĶ¼ŹĒN2(g)ŗĶH2(g)·“Ӧɜ³É1mol NH3(g)¹ż³ĢÖŠÄÜĮæ±ä»ÆŹ¾ŅāĶ¼£¬ĒėŠ“³öN2ŗĶH2·“Ó¦µÄČČ»Æѧ·½³ĢŹ½£ŗ ”£
£Ø2£©ČōŅŃÖŖĻĀĮŠŹż¾Ż£ŗ
| »Æѧ¼ü | H£H | N”ŌN |
| ¼üÄÜ/kJ”¤mol£1 | 435 | 943 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
¢ń£®ŗćĪĀ£¬ČŻ»żĪŖ1 LŗćČŻĢõ¼žĻĀ£¬ĮņæÉŅŌ·¢ÉśČēĻĀ×Ŗ»Æ£¬Ęä·“Ó¦¹ż³ĢŗĶÄÜĮæ¹ŲĻµČēĶ¼1ĖłŹ¾(ŅŃÖŖ£ŗ2SO2(g)£«O2(g)  2SO3(g) ¦¤H£½£196.6 kJ”¤mol£1)£¬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
2SO3(g) ¦¤H£½£196.6 kJ”¤mol£1)£¬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)Š“³öÄܱķŹ¾ĮņµÄČ¼ÉÕČȵÄČČ»Æѧ·½³ĢŹ½£ŗ______________________”£
(2)¦¤H2£½__________kJ”¤mol£1”£
¢ņ.¹¤ŅµÉĻ³£ĄūÓĆ“×ĖįŗĶŅŅ“¼ŗĻ³ÉÓŠ»śČܼĮŅŅĖįŅŅõ„£ŗ
CH3COOH(l)£«C2H5OH(l)  CH3COOC2H5(l)£«H2O(l) ¦¤H£½£8.62 kJ”¤mol£1
CH3COOC2H5(l)£«H2O(l) ¦¤H£½£8.62 kJ”¤mol£1
ŅŃÖŖCH3COOH”¢C2H5OHŗĶCH3COOC2H5µÄ·ŠµćŅĄ“ĪĪŖ118 ”ę”¢78 ”ęŗĶ77 ”ę”£ŌŚĘäĖūĢõ¼žĻąĶ¬Ź±£¬Ä³ŃŠ¾æŠ”×é½ųŠŠĮĖ¶ą“ĪŹµŃ飬ŹµŃé½į¹ūČēĶ¼ĖłŹ¾”£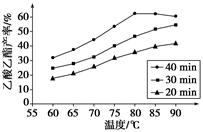
(1)øĆŃŠ¾æŠ”×éµÄŹµŃéÄæµÄŹĒ___________________________________”£
(2)60 ”ęĻĀ·“Ó¦40 minÓė70 ”ęĻĀ·“Ó¦20 minĻą±Č£¬Ē°ÕßµÄĘ½¾ł·“Ó¦ĖŁĀŹ________ŗóÕß(Ģī”°Š”ÓŚ”±”¢”°µČÓŚ”±»ņ”°“óÓŚ”±)”£
(3)ČēĶ¼ĖłŹ¾£¬·“Ó¦Ź±¼äĪŖ40 min”¢ĪĀ¶Č³¬¹ż80 ”ꏱ£¬ŅŅĖįŅŅõ„²śĀŹĻĀ½µµÄŌŅņæÉÄÜŹĒ_________________________________(Š“³öĮ½Ģõ)”£
¢ó.Ćŗ»Æ¹¤ÖŠ³£ŠčŃŠ¾æ²»Ķ¬ĪĀ¶ČĻĀĘ½ŗā³£Źż”¢Ķ¶ĮĻ±Č¼°ČČÖµµČĪŹĢā”£
ŅŃÖŖ£ŗCO(g)£«H2O(g)  H2(g)£«CO2(g)Ę½ŗā³£ŹżĖęĪĀ¶ČµÄ±ä»ÆČēĻĀ±ķ£ŗ
H2(g)£«CO2(g)Ę½ŗā³£ŹżĖęĪĀ¶ČµÄ±ä»ÆČēĻĀ±ķ£ŗ
| ĪĀ¶Č/”ę | 400 | 500 | 800 |
| Ę½ŗā³£ŹżK | 9.94 | 9 | 1 |
| | n(CO) | n(H2O) | n(H2) | n(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
 2CO(g)Ę½ŗā³£ŹżĪŖK£»
2CO(g)Ę½ŗā³£ŹżĪŖK£» CO(g)£«H2(g) Ę½ŗā³£ŹżĪŖK1£»
CO(g)£«H2(g) Ę½ŗā³£ŹżĪŖK1£» H2(g)£«CO2(g) Ę½ŗā³£ŹżĪŖK2£»
H2(g)£«CO2(g) Ę½ŗā³£ŹżĪŖK2£»²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ÕÓĘų£ØÖ÷ŅŖ³É·ÖŹĒ¼×Ķ飩ŹĒŅ»ÖÖĮ®¼ŪµÄÄÜŌ“£¬°ŃÅ©“åÖŠ“óĮæ“ęŌŚµÄÅ©×÷Īļ½ÕøŃ”¢ŌÓ²Ż”¢ČĖŠó·ą±ćµČŌŚÕÓĘų³ŲÖŠ·¢½Ķ£¬±ćæɲśÉśÕÓĘų£¬ÕÓĘųĶźČ«Č¼ÉÕæÉŅŌÓĆĄ“µćµĘ”¢×ö·¹”£
£Ø1£©ŌŚ101kPaŹ±£¬32gCH4Č¼ÉÕÉś³ÉCO2ŗĶĘųĢ¬H2O£¬·Å³ö1604kJµÄČČĮ棬Š“³ö¼×ĶéČ¼ÉÕµÄČČ»Æѧ·½³ĢŹ½ĪŖ__________________________________________________________”£
£Ø2£©120”ę£¬Č”CH4ŗĶ¹żĮæO2µÄ»ģŗĻĘųĢå¹²0.4mol£¬µćČ¼Ź¹Ęä³ä·Ö·“Ó¦£¬½«Č¼ÉÕŗóµÄĘųĢåĶعż×ćĮæµÄ¼īŹÆ»Ņ£ØNaOHŗĶCaOµÄ¹ĢĢå»ģŗĻĪļ£©³ä·ÖĪüŹÕ£¬¼īŹÆ»ŅŌöÖŲ8g”£¼ĘĖć£ŗŌ»ģŗĻĘųĢåÖŠCH4ŗĶO2µÄĢå»ż±ČŹĒ¶ąÉŁ£æ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
°±ŹĒŅ»ÖÖÖŲŅŖµÄ»Æ¹¤²śĘ·£¬ŹĒµŖ·Ź¹¤Ņµ”¢ÓŠ»śŗĻ³É¹¤ŅµŅŌ¼°ÖĘŌģĻõĖį”¢ļ§ŃĪŗĶ“æ¼īµÄŌĮĻ£¬Ņ²ŹĒŅ»ÖÖ³£ÓƵÄÖĘĄä¼Į”£
(1) ŹµŃéŹŅÖʱø°±ĘųµÄ»Æѧ·“Ó¦·½³ĢŹ½ĪŖ_________”£
(2) ¹¤ŅµŗĻ³É°±µÄ·“Ó¦·½³ĢŹ½ĪŖ£ŗN2(g)£«3H2(g) 2NH3(g) ”÷H”£ĻĀĶ¼IŹĒŗĻ³É°±·“Ó¦µÄÄÜĮæÓė·“Ó¦¹ż³ĢĻą¹ŲĶ¼£ØĪ“Ź¹ÓĆ“ß»Æ¼Į£©£»Ķ¼DŹĒŗĻ³ÉŻ·“Ó¦ŌŚ2LČŻĘ÷ÖŠ”¢ĻąĶ¬Ķ¶ĮĻĒéæöĻĀ”¢ĘäĖüĢõ¼ž¶¼²»±äŹ±£¬Ä³Ņ»·“Ó¦Ģõ¼žµÄøıä¶Ō·“Ó¦µÄÓ°ĻģĶ¼”£
2NH3(g) ”÷H”£ĻĀĶ¼IŹĒŗĻ³É°±·“Ó¦µÄÄÜĮæÓė·“Ó¦¹ż³ĢĻą¹ŲĶ¼£ØĪ“Ź¹ÓĆ“ß»Æ¼Į£©£»Ķ¼DŹĒŗĻ³ÉŻ·“Ó¦ŌŚ2LČŻĘ÷ÖŠ”¢ĻąĶ¬Ķ¶ĮĻĒéæöĻĀ”¢ĘäĖüĢõ¼ž¶¼²»±äŹ±£¬Ä³Ņ»·“Ó¦Ģõ¼žµÄøıä¶Ō·“Ó¦µÄÓ°ĻģĶ¼”£
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ_______”£
| A£®¦¤H£½£92.4kJ/mol |
| B£®Ź¹ÓĆ“ß»Æ¼Į»įŹ¹E1µÄŹżÖµŌö“ó |
| C£®ĪŖĮĖĢįøß×Ŗ»ÆĀŹ£¬¹¤ŅµÉś²śÖŠ·“Ó¦µÄÅضČŌ½µĶŌ½ŗĆ |
| D£®Ķ¼IIŹĒ²»Ķ¬Ń¹ĒæĻĀ·“Ó¦ĢåĻµÖŠ°±µÄĪļÖŹµÄĮæÓė·“Ó¦Ź±¼ä¹ŲĻµĶ¼£¬ĒŅPA<PB |
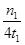 mol/(L”¤min)
mol/(L”¤min)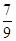 ±¶£¬Ōņ“ĖĪĀ¶ČĻĀµÄĘ½ŗā³£ŹżĪŖ_______”£ŌŚĶ¬Ņ»ĪĀ¶Č£¬Ķ¬Ņ»ČŻĘ÷ÖŠ£¬½«ĘšŹ¼ĪļÖŹøÄĪŖamol N2 b molH2 c mol NH3 (a,b,c¾ł²»ĪŖĮć£©ÓūŹ¹Ę½ŗā»ģŗĻĪļÖŠø÷ĪļÖŹµÄÖŹĮæÓėŌĘ½ŗāĻąĶ¬£¬Ōņa,b,cĀś×ćµÄ¹ŲĻµĪŖ_____________(ÓĆŗ¬a,b,cµÄ±ķ“ļŹ½±ķŹ¾£©£¬ĒŅÓūŹ¹·“Ó¦ŌŚĘšŹ¼Ź±ĻņÄę·“Ó¦·½Ļņ½ųŠŠ£¬cµÄȔֵ·¶Ī§ŹĒ_______
±¶£¬Ōņ“ĖĪĀ¶ČĻĀµÄĘ½ŗā³£ŹżĪŖ_______”£ŌŚĶ¬Ņ»ĪĀ¶Č£¬Ķ¬Ņ»ČŻĘ÷ÖŠ£¬½«ĘšŹ¼ĪļÖŹøÄĪŖamol N2 b molH2 c mol NH3 (a,b,c¾ł²»ĪŖĮć£©ÓūŹ¹Ę½ŗā»ģŗĻĪļÖŠø÷ĪļÖŹµÄÖŹĮæÓėŌĘ½ŗāĻąĶ¬£¬Ōņa,b,cĀś×ćµÄ¹ŲĻµĪŖ_____________(ÓĆŗ¬a,b,cµÄ±ķ“ļŹ½±ķŹ¾£©£¬ĒŅÓūŹ¹·“Ó¦ŌŚĘšŹ¼Ź±ĻņÄę·“Ó¦·½Ļņ½ųŠŠ£¬cµÄȔֵ·¶Ī§ŹĒ_______²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ÄÜŌ“ŹĒĻÖ“śÉē»į·¢Õ¹µÄÖ§ÖłÖ®Ņ»”£
£Ø1£©»Æѧ·“Ó¦ÖŠµÄÄÜĮæ±ä»Æ£¬Ķس£Ö÷ŅŖ±ķĻÖĪŖČČĮæµÄ±ä»Æ”£
¢ŁĻĀĮŠ·“Ó¦ÖŠ£¬ŹōÓŚ·ÅČČ·“Ó¦µÄŹĒ___________£ØĢīŠņŗÅ£©”£
a. Ba£ØOH£©2”¤8H2OÓėNH4Cl»ģŗĻ½Į°č
b. øßĪĀģŃÉÕŹÆ»ŅŹÆ
c. ĀĮÓėŃĪĖį·“Ó¦
¢ŚÄ³Ķ¬Ń§½ųŠŠČēĻĀĶ¼ĖłŹ¾ŹµŃ飬²āĮæĻ”ŃĪĖįÓėÉÕ¼īČÜŅŗÖŠŗĶ·“Ó¦µÄÄÜĮæ±ä»Æ”£ŹµŃé±ķĆ÷£ŗ·“Ó¦ĪĀ¶ČÉżøߣ¬ÓÉ“ĖÅŠ¶ĻøĆ·“Ó¦ŹĒ_______£ØĢī”°ĪüČČ”±»ņ”°·ÅČČ”±£©·“Ó¦£¬ĘäĄė×Ó·½³ĢŹ½ŹĒ_______________”£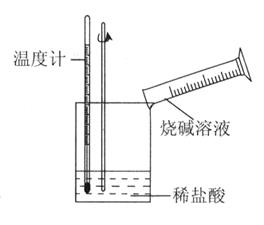
£Ø2£©µēÄÜŹĒĻÖ“śÉē»įÓ¦ÓĆ×ī¹ć·ŗµÄÄÜŌ“Ö®Ņ»”£
ĻĀĶ¼ĖłŹ¾µÄŌµē³Ų×°ÖĆÖŠ£¬Ęäøŗ¼«ŹĒ_____________________£¬Õż¼«ÉĻÄܹ»¹Ū²ģµ½µÄĻÖĻóŹĒ____________________________£¬Õż¼«µÄµē¼«·“Ó¦Ź½ŹĒ_________________________”£
Ōµē³Ų¹¤×÷Ņ»¶ĪŹ±¼äŗó£¬ČōĻūŗÄŠæ6.5g£¬Ōņ·Å³öĘųĢå__________g”£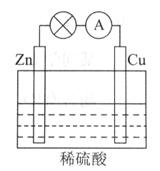
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com