
| A. | ρ1>ρ2>ρ3>ρ4 | B. | ρ1>ρ2>ρ4>ρ3 | C. | ρ2>ρ1>ρ3>ρ4 | D. | ρ2>ρ1>ρ4>ρ3 |
分析 因硫酸溶液的密度大于水的密度,而乙醇水溶液的密度小于水的密度,故ρ1、ρ2一定大于ρ3、ρ4;
对于原来的硫酸溶液,质量分数越大密度越大,设原来混合前两种硫酸溶液的密度为ρa和ρb,且密度ρa>ρb,等体积混合后密度ρ2应介于ρa和ρb之间,等质量混合可假设如下过程:在等体积混合后再加入一定质量的密度较小的溶液至两种溶液质量相等,此时所得溶液的密度ρ1必介于ρ2和ρb之间,即 ρa>ρ2>ρ1>ρb;
同理可得乙醇溶液混合后所得溶液的密度 ρ4>ρ3.
解答 解:因硫酸溶液的密度大于水的密度,而乙醇水溶液的密度小于水的密度,故ρ1、ρ2一定大于ρ3、ρ4;
对于原来的硫酸溶液,质量分数越大密度越大,设原来混合前两种硫酸溶液的密度为ρa和ρb,且密度ρa>ρb,等体积混合后密度ρ2应介于ρa和ρb之间,等质量混合可假设如下过程:在等体积混合后再加入一定质量的密度较小的溶液至两种溶液质量相等,此时所得溶液的密度ρ1必介于ρ2和ρb之间,即 ρa>ρ2>ρ1>ρb,由此可知,两溶液混合进行密度比较时,均可设为往密度较大的溶液中加入密度较小的溶液至等体积时,再继续加入密度较小的溶液至等质量混合.这一过程可看作密度减小的“稀释”过程.这样假设过程比较,可以发现如下规律:等质量混合时所得溶液的密度必小于等体积混合时所得溶液的密度,即乙醇溶液混合后所得溶液的密度 ρ4>ρ3;综合可得ρ2>ρ1>ρ4>ρ3,故选D.
点评 本题考查混合溶液密度计算,为高频考点,侧重考查学生分析判断能力,明确硫酸、乙醇浓度与密度关系是解本题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氯气通入冷水中:Cl2+H2O?Cl-+ClO-+2H+ | |
| B. | 亚硫酸氨溶液与足量氢氧化钠溶液反应 HSO3-+OH-═SO32-+H2O | |
| C. | 氢氧化钠溶液吸收过量的二氧化碳 OH-+CO2═HCO3- | |
| D. | 碳酸镁悬浊液中加醋酸 CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
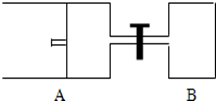
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
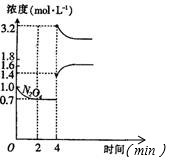
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同质量、不同密度的C2H4和C3H6 | B. | 同质量、不同体积的CO和N2 | ||
| C. | 同体积、同密度的N2O和CO2 | D. | 同压强、同体积的CO2和SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+、NH4+、Fe3+、Ba2+ |
| 阴离子 | Cl-、CO32-、HCO3-、SO42- |
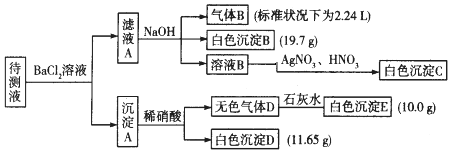
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com