
将15.6g Na2O2与2.7g Al粉混合后,投入足量的水中,充分反应(设能产生的气体全部放出)。
(1)Na2O2与水反应的化学方程式为 ,15.6g Na2O2在该反应中转移电子的物质的量为 mol。
(2)反应结束时生成的气体在标准状况下为 L。
(3)取a g Na2O2与Al粉组成的混合物,放入适量的水中,固体完全溶解,在标准状况下
放出气体V L,则V的取值范围是 (用含a的代数式表示,结果可不化简)。
1)2Na2O2+2H2O=4NaOH+O2↑;0.2mol (2)5.6L
(3)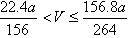
解析试题分析:(1)Na2O2与水反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑;该反应转移的电子数为2,即2molNa2O2参加反应,转移的电子数为2mol,15.6g Na2O2为0.2mol,所以5.6g Na2O2在该反应中转移电子的物质的量为0.2mol;2)反应结束时生成的气体有一部分是氢气,一部分是氧气,生产的氧气的体积V1=0.2/2×22.4=2.24L,铝与NaOH的反应为
2Al+2NaOH+2H2O=2NaAlO2+3H2↑,所以生产的氢气的体积V2=2.7/27×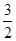 ×22.4=3.36L,所以反应结束时生成的气体在标准状况下2.24+3.36=5.6L;(3)设Na2O2物质的量为xmol ,Al 物质的量为ymol根据,
×22.4=3.36L,所以反应结束时生成的气体在标准状况下2.24+3.36=5.6L;(3)设Na2O2物质的量为xmol ,Al 物质的量为ymol根据,
2Na2O2+2H2O=4NaOH+O2↑ 2Al2Al+2NaOH+2H2O=2NaAlO2+3H2↑可以知道
相同质量的Al比Na2O2产生的气体要多,所以当Al越多气体越多,但是要固体完全溶解,因此当Al与Na2O2产生的NaOH恰好反应时气体最多。此时
78x+27y=a y=2x V=(x/2+3y/2)×22.4 ,而x=a/132,y=2a/132,所以V=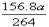
相反,Al越少气体越少,当Al为0时,产生的气体最少,此时
V=22.4×x/2=(22.4×a)/(2×78)=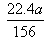 ,但却不能达到,所以V的取值范围是
,但却不能达到,所以V的取值范围是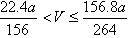 。
。
考点:元素及其化合物
点评: 本题考查了元素及其化合物的计算,该题的设计有一定的难度推度,最后一个空难度较大。
本题考查了元素及其化合物的计算,该题的设计有一定的难度推度,最后一个空难度较大。


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、最终得到7.8g沉淀 | B、最终溶液:c(Na+)=c(Cl-)+c(OH-) | C、标准状况下,反应过程中得到6.72L气体 | D、最终溶液:c(Na+)=1.5mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com