
【题目】15.8g KMnO4氧化密度为1.19 g/cm3,溶质质量分数为36.5%的HCl,反应方程式如下:2KMnO4 + 16HCl =2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O。
(1)该盐酸中HCl的物质的量浓度是______________________________。
(2)被氧化的HCl的物质的量为________________________。
(3)求产生的Cl 2在标准状况下的体积(依据化学方程式进行计算,要求写出计算过程)_______。
【答案】 11.9 mol/L 0.5 mol 设Cl2在标准状况下的体积为V,则
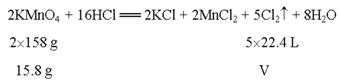
列方程为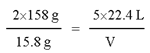
求得V= 5.6 L,即Cl2在标准状况下的体积为5.6 L。
【解析】(1)c(HCl)=![]() =11.9mol/L。
=11.9mol/L。
故答案为:11.9mol/L;
(2)n(KMnO4)=![]() =0.1mol,由方程式可知,2molKMnO4参加反应,有10molHCl被氧化,则0.1molKMnO4参加反应,有0.5molHCl被氧化。
=0.1mol,由方程式可知,2molKMnO4参加反应,有10molHCl被氧化,则0.1molKMnO4参加反应,有0.5molHCl被氧化。
故答案为:0.5mol;
(3)设产生的Cl2在标准状况下的体积为V,则
2KMnO4 +16HCl =2KCl+2MnCl 2+5Cl 2↑+8H2O
2×158g 5×22.4L
15.8g V
列方程式得:
![]()
解得:V=5.6L,即产生的Cl2在标准状况下的体积为5.6L。


科目:高中化学 来源: 题型:
【题目】核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域.已知只有质子数或中子数为奇数的原子核才有NMR现象.试判断下列哪组原子均可产生NMR现象( )
A.18O、31P、119Sn
B.27Al、19F、12C
C.7N、15P、33As、51Sb、83Bi
D.只有一个电子层的原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一定体积CH4、C2H6、C3H8组成的混合气体,是同温同压下H2密度的15倍。则混合气体中CH4、C2H6、C3H8、的体积比不可能是: ( )
A. 2∶1∶2 B. 2∶3∶1 C. 1∶4∶1 D. 5∶3∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中能大量共存的是( )
A.H+、AlO2-、CO32-B.K+、Ba2+、SO42-
C.NH4+、OH-、NO3-D.Fe3+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐是日常生活的必需品,也是重要的化工原料.粗食盐常含有少量Ca2+、Mg2+、SO42﹣等杂质离子,实验室提纯NaCl的流程如图: 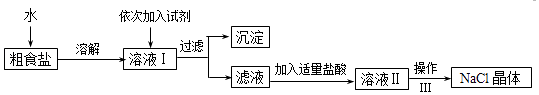
提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液
(1)从上述提供的试剂中选出适当的试剂除去溶液I中的Ca2+、Mg2+、SO42﹣离子,滴加顺序依次为、、(只填化学式).
(2)操作Ⅲ的名称是 , 所需用到的仪器主要有铁架台、酒精灯、铁圈、(填仪器名称).
(3)加盐酸的目的是(用离子方程式表示)、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+mY(g)3Z(g),平衡时,X,Y,Z的体积分数分别为30%、60%、10%,在此平衡体系中加入1molZ(g),再将达到平衡后,X,Y,Z的体积分数不变.下列叙述不正确的是( )
A.m=2
B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1:1
D.第二次平衡时,Z的浓度为0.4molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是____________。
(2)该反应中,发生还原反应的过程是______________→____________。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目_____________。
(4)如反应转移了0.3 mol电子,则产生的气体在标准状况下的体积为 。
(5)已知I-、Fe2+、SO2、Cl-、H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:SO2>I->H2O2>Fe2+>Cl-,则下列反应不能发生的是( )
A.2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
B.I2+SO2+2H2O=H2SO4+2HI |
C.H2O2+H2SO4=SO2↑+O2↑+2H2O |
D.2Fe3++2I-=2Fe2++I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com