
 酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
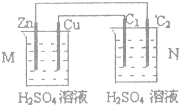
| A、C1上发生还原反应 |
| B、M装置中SO2-4移向Cu电极 |
| C、工作一段时间后装置M中溶液PH变大,装置N中溶液PH变小 |
| D、Cu电极与C2电极上的电极反应不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
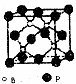 硼是新型无机材料中的明星元素.
硼是新型无机材料中的明星元素.查看答案和解析>>
科目:高中化学 来源: 题型:
A、铝热反应制取金属钨:WO3+2Al
| ||||
| B、红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:3Fe+4H2O(g)═Fe3O4+4H2 | ||||
| C、“84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用时会放出氯气:ClO-+Cl-+2H+=Cl2↑+H2O | ||||
| D、在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+3H2O2+2H+=I2+O2↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
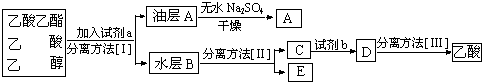
查看答案和解析>>
科目:高中化学 来源: 题型:
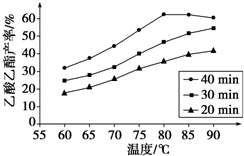 工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:
工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:| 浓硫酸 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
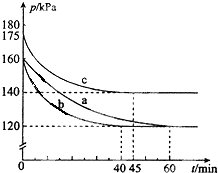 化合物PCl3和单质Cl2在一定条件下反应可生成化合物PCl5.回答下列问题:
化合物PCl3和单质Cl2在一定条件下反应可生成化合物PCl5.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com