
| A. | 原子半径:A<B<C | |
| B. | 三种元素的最高价氧化物对应水化物均可由化合反应得到 | |
| C. | A的氢化物稳定性小于C的氢化物稳定性 | |
| D. | B 和A的最高价氧化物可发生置换反应 |
分析 短周期元素A、B、C的原子序数依次递增,它们的原子最外层电子数之和为10,A与C同主族,B原子的最外层电子数等于A原子的次外层电子数,B的最外层电子数为2,A、C的最外层电子数为$\frac{10-2}{2}$=4,则A为C,B为Mg,C为Si,以此来解答.
解答 解:由上述分析可知,A为C,B为Mg,C为Si,
A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径:A<C<B,故A错误;
B.MgO与水不能化合生成氢氧化镁,二氧化硅不能与水化合生成硅酸,故B错误;
C.非金属性A>C,则A的氢化物稳定性大于C的氢化物稳定性,故C错误;
D.B 和A的最高价氧化物可发生置换反应,生成MgO和C,故D正确;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、元素的位置来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:实验题
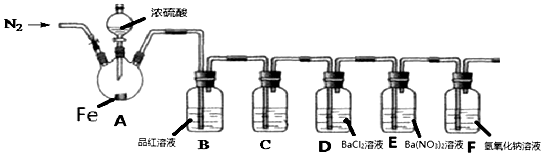
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E都是周期表中前四周期的元素,它们的原子序数依次增大.其中A元素原子的核外p电子数比s电子数少1.C是电负性最大的元素.D原子次外层电子数是最外层电子数2倍,E是第Ⅷ族中原子序数最小的元素.
已知A、B、C、D、E都是周期表中前四周期的元素,它们的原子序数依次增大.其中A元素原子的核外p电子数比s电子数少1.C是电负性最大的元素.D原子次外层电子数是最外层电子数2倍,E是第Ⅷ族中原子序数最小的元素.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的pH<7 | B. | 得到澄清透明溶液 | ||
| C. | 得到浑浊液 | D. | 先有白色沉淀生成,后逐渐溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化合物 | NaF | MgF2 | MgO | SiF4 | SiO2 |
| 熔点/K | 1266 | 1534 | 3125 | 183 | 1983 |
| 摩氏硬度 | 3,2 | 6.0 | 6.5 | 7 |
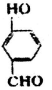 比
比 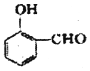 的沸点高(填“高”或“低”).
的沸点高(填“高”或“低”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “化学--人类进步的关键”.化学在生产生活中有着广泛的运用,尤其是化学反应原理.人们平时所用的铁及其化合物都跟化学有关.
“化学--人类进步的关键”.化学在生产生活中有着广泛的运用,尤其是化学反应原理.人们平时所用的铁及其化合物都跟化学有关.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 | 向试管中加入2ml溶液 | 实验现象 |
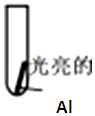 | 实验Ⅰ:0.5mol/LCuCl2溶液 | 15s:大量气泡且有红色物质析出 60s:反应进一步加快且反应剧烈放热,液体几乎沸腾 120s:铝片反应完,试管中析出大量蓬松的红色物质 |
| 实验Ⅱ:0.5mol/LCuSO4溶液 | 15s 无明显现象 60s:铝片表面有极少气泡 120s:有少量气泡溢出,铝片边缘有很少红色物质生成 |
| 实验 | 向试管中加入2mL溶液 | 实验现象 |
 | 实验Ⅲ:0.5mol/LCuCl2溶液+1g Na2SO4固体 | 加入 Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 |
| 实验Ⅳ:0.5mol/L CuCl2溶液+5g Na2SO4固体 | 加入Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 | |
| 实验Ⅴ:0.5mol/LCuSO4溶液+0.02mol NaCl固体 | 未加入 NaCl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 | |
| 实验Ⅵ:0.5mol/LCuSO4溶液+0.02mol NH4Cl固体 | 未加入 NH4Cl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
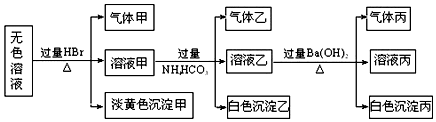
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com