
| A.可用浓硝酸除去铝制品表面的铜镀层 |
B.用催化法处理汽车尾气中的CO和NO:CO+NO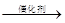 C+NO2 C+NO2 |
| C.浓硫酸具有吸水性,因此可用作干燥剂,能干燥氢气、硫化氢、氨气等气体 |
| D.因为浓硫酸在常温下不可与铁或铝反应,因此常温下可用铁制或铝制容器储存浓硫酸 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
A.Cu+2H2SO4(浓)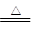 CuSO4+SO2↑+2H2O CuSO4+SO2↑+2H2O |
B.C+4HNO3(浓) 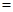 CO2↑+4NO2↑+2H2O CO2↑+4NO2↑+2H2O |
| C.3Fe+8HNO3(稀) = 3Fe(NO3)2+2NO↑+4H2O |
| D.CuO+H2SO4(稀) = CuSO4+H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
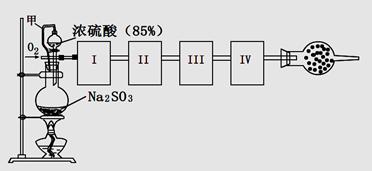
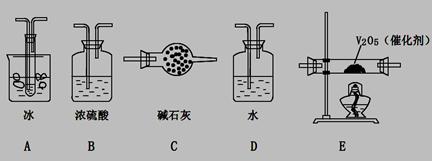
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CaSO4 | B.CaSO3 | C.CaS | D.SO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
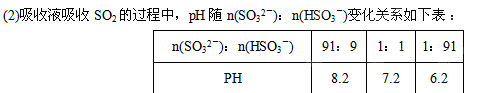
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
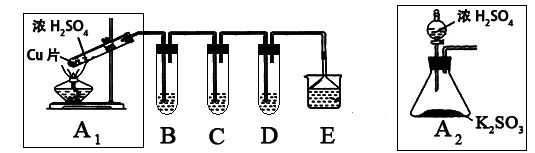
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量。 | 若出现白色浑浊,则溶液中存在SO32-或 SO42-。 |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体_______________ _______________________________________________________ | _________________________ ____________________________ |
| 步骤3______________________________________________ ____________________________________________________ | _________________________ _________________________ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
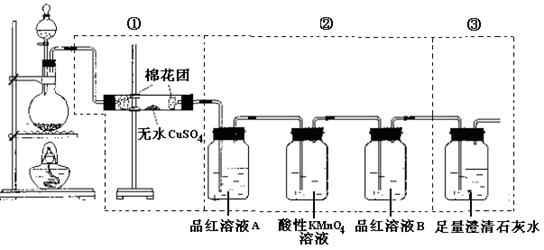
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.都能证明 | B.都不能证明 | C.③⑤ | D.③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com