
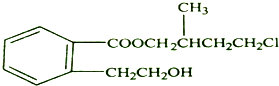
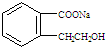
 .
.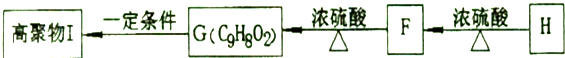
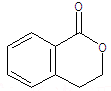 .②由F生成的G化学方程式
.②由F生成的G化学方程式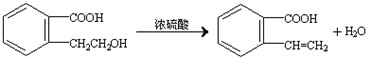 .
.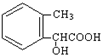 .
.分析 (1)由结构简式可知分子式;
(2)A中含-COOC-可发生水解反应,C中含苯环;
(3)C酸化后可得F,F中含-COOH、-OH,结合羧酸、醇及苯的性质分析;
(4)B为CH3CH(OH)CH2CH2OH,酯化反应中M(B)+2M(D)=M(E)+2M(H2O);
(5)由转化关系可知,F→H发生分子内酯化反应,F→G发生醇的消去反应,G→I发生加聚反应;
(6)F的同分异构体符合:①含有邻二取代苯环结构②与F具有相同的官能团 ③不与FeCl3溶液发生显色反应,则邻位2个取代基上含1个-OH、1个-COOH,-OH、-COOH可均在同一个取代基上.
解答 解:(1)由结构简式可知分子式为C14H19O3Cl,故答案为:C14H19O3Cl;
(2)A中含-COOC-可发生水解反应,C中含苯环,则C的结构简式为 ,故答案为:
,故答案为: ;
;
(3)C为 ,C酸化后可得F,F中含-COOH、-OH,则
,C酸化后可得F,F中含-COOH、-OH,则
a.含-OH、-COOH,可发生取代反应,故不选;
b.含苯环,可发生加成反应,故不选;
c.含-OH,可发生消去反应,故不选;
d.不含双键或三键,不能发生加聚反应,故选;
e.哈-OH,可发生氧化反应,故不选;
故答案为:d;
(4)B为CH3CH(OH)CH2CH2OH,酯化反应中M(B)+2M(D)=M(E)+2M(H2O),则M(D)=$\frac{84+2×18}{2}$=60g/mol,故答案为:60g/mol;
(5)①由转化关系可知,F→H发生分子内酯化反应,则H为 ,故答案为:
,故答案为: ;
;
②F→G发生醇的消去反应,该反应为 ,
,
故答案为: ;
;
(6)F的同分异构体符合:①含有邻二取代苯环结构②与F具有相同的官能团 ③不与FeCl3溶液发生显色反应,则邻位2个取代基上含1个-OH、1个-COOH,-OH、-COOH可均在同一个取代基上,如 ,故答案为:
,故答案为: .
.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与推断能力、综合应用能力的考查,(6)为解答的难点,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1 mol Fe与过量的稀HNO3反应,转移2 NA个电子 | |
| B. | 常温常压下,22.4L的NO2和CO2合气体含有2 NA个O 原子 | |
| C. | 1 L 0.1 mol•L-1NaHCO3液含有0.1 NA个HCO3- | |
| D. | 常温下,4gCH4含有NA个C-H共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2a | B. | (2+$\frac{S}{100}$)a | C. | $\frac{200a}{100-S}$ | D. | (1+$\frac{S}{50}$)a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 37Cl与39K具有相同的中子数 | |
| B. | 第114号元素的一种核素${\;}_{114}^{298}X$与${\;}_{82}^{207}Pb$具有相同的最外层电子数 | |
| C. | O22-与S2-具有相同的质子数和电子数 | |
| D. | H3O+与OH-具有相同的质子数和电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将Na加入CuSO4溶液中:Na+Cu2+=Cu+2Na+ | |
| B. | 将NaHSO4溶液加入Ba(OH)2溶液中至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| C. | 向氯化铝溶液中加入足量氨水:AI3++4NH3•H2O=AIO2-+2H2O+4NH4+ | |
| D. | 向Ca(OH2)溶液中通入过量SO2:SO2+OH-=HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ①③④ | C. | ②④ | D. | 只有⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组 | ①组 | ②组 | ③组 | ④组 |
| 分类标准 | 非金属 | 无氧酸 | 碱性氧化物 | |
| 异类物质 | NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.50 | 20.00 |
| 2 | 0.10 | 18.56 | 20.00 |
| 3 | 0.10 | 18.54 | 20.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com