
【题目】物质的类别和核心元素的化合价是研究物质性质的两个基本视角。
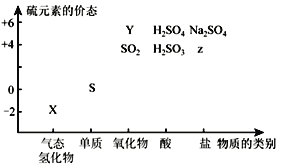

(1)图中Y物质的化学式为______。
(2)治理含CO、SO2的烟道气,可以将其在催化剂作用下转化为单质S和无毒的气体.则治理烟道气反应的化学方程式为____________________________。
(3)实验室中X气体由不溶性的硫化亚铁(FeS)固体和稀硫酸混合反应制得,该反应的离子方程式为:_____________________________________________。
(4)Na2S2O3(硫代硫酸钠)是一种用途广泛的钠盐。
①下列物质用于Na2S2O3的制备,从氧化还原反应的角度,理论上有可能的是___。
a.Na2S+S b.Z+S c.Na2SO3+Y d.NaHS+NaHSO3
②Na2S2O3具有较强还原性,能作为织锦物漂白后的脱氯剂,脱氯后S2O32-转变为SO42-。 现需处理含标准状况下Cl2 2.24L的织锦物,理论上需要0.00100mol/L Na2S2O3溶液的体积为_______L。
【答案】SO3 2CO+SO2 ![]() 2CO2+S FeS+2H+=Fe2++H2S↑ bd 25
2CO2+S FeS+2H+=Fe2++H2S↑ bd 25
【解析】
依据元素化合价和物质分类分析,X为气态氢化物为H2S,Y为硫元素的+6价氧化物为SO3,Z为+4价的盐可以为Na2SO3。
(1)Y是S元素化合价为+6价;
(2)根据反应物、生成物,结合反应中电子转移数目相等,可得反应方程式;
(3)FeS与稀硫酸发生复分解反应产生H2S和FeSO4,根据离子方程式中物质拆分原则书写反应的离子方程式;
(4)①Na2S2O3中S为+2价,从氧化还原的角度分析,反应物中S元素化合价必须分别大于2和小于2;
②根据元素化合价升降总数相等,计算反应消耗的Na2S2O3的物质的量,再根据n=cV计算其物质的量。
根据上述推断可知X是H2S,Y是SO3,Z是Na2SO3。
(1)Y为S元素的氧化物,化合价为+6价,则Y为SO3;
(2) CO、SO2反应产生S单质和CO2,根据电子守恒、原子守恒,可得反应方程式为:2CO+SO2 ![]() 2CO2+S;
2CO2+S;
(3)FeS与稀硫酸发生复分解反应产生H2S和FeSO4,反应的离子方程式为:FeS+2H+=Fe2++H2S↑;
(4)①Na2S2O3中S为+2价,从氧化还原的角度分析,反应物中S元素化合价必须分别大于2和小于2,A中S化合价都小于2,C中物质中S化合价都大于+2价,B、D中S元素化合价必须分别大于2和小于2,故合理选项是bd;
②根据题干信息可知发生反应方程式为:Na2S2O3+4Cl2+5H2O=2NaCl+2H2SO4+6HCl,标准状况下2.24L Cl2的物质的量是n(Cl2)=2.24L÷22.4L/mol=0.1mol,在反应中获得电子变为-1价的Cl-,0.1molCl2获得电子的物质的量是0.2mol;S2O32-转变为SO42-,每1mol S2O32-失去8mol电子,则转移0.2mol电子,需消耗S2O32-的物质的量n(S2O32-)=0.2mol÷8=0.025mol,根据n=c·V可知理论上需要0.00100mol/L Na2S2O3溶液的体积V=0.025mol÷0.00100mol/L=25L。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】氮化镁(Mg3N2)在工业上具有非常广泛的应用。某化学兴趣小组用镁和氮气反应制备Mg3N2并进行有关实验。实验装置如图所示:
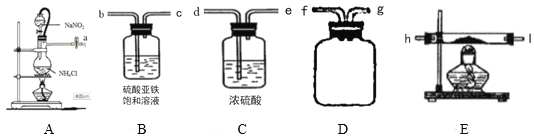
已知:①氮化镁常温下为浅黄色粉末,极易与水反应生成一种有刺激性气味的气体。
②亚硝酸钠和氯化铵制取氮气的反应剧烈放热,产生氮气的速度较快。
③温度较高时,亚硝酸钠会分解产生O2等。
④硫酸亚铁具有还原性,容易被氧化。
回答下列同题:
(1)写出制取N2发生反应的化学方程式___。
(2)实验获置(可重复使用)的连接顺序为:a→___,___→___,___→___,___→h,i→___。
(3)某同学检验A装置的气密性,关闭止水夹K后,开启分液漏斗活塞,水不断往下滴,直至全部流入烧瓶,试判断:A装置是否漏气?___(填“漏气”“不漏气”或“无法确定”)。
(4)装置B中为饱和硫酸亚铁溶液,作用是___。
(5)加热至反应开始发生,需移走A处酒精灯,原因是___。
(6)反应结束后,取m g E中样品于试管中,加足量蒸馏水,有刺激性气味气体产生,再向剩余固体中加稀硫酸,得VmL气体(换算为标准状况),则样品中氮化镁的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在NH3和NH4Cl存在条件下,以活性炭为催化剂,用H2O2氧化CoCl2溶液来制备化工产品[Co(NH3)6]Cl3,下列表述正确的是
A. [Co(NH3)6]Cl3中Co的化合价是+3B. H2O2 的电子式:![]()
C. NH3和NH4Cl化学键类型相同D. 中子数为32,质子数为27的钴原子:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Bodensteins研究反应H2(g)+I2(g)![]() 2HI(g) △H<0 ,温度为T时,在两个体积均为1L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w(HI)与反应时间t的关系如下表:
2HI(g) △H<0 ,温度为T时,在两个体积均为1L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w(HI)与反应时间t的关系如下表:
容器编号 | 起始物质 | t/min | 0 | 20 | 40 | 60 | 80 | 100 |
Ⅰ | 0.5molI2、0.5molH2 | w(HI)/% | 0 | 50 | 68 | 76 | 80 | 80 |
Ⅱ | xmolHI | w(HI)/% | 100 | 91 | 84 | 81 | 80 | 80 |
研究发现上述反应中:v正=kaw(H2)w(I2),v逆=kbw2(HI),其中ka、kb为常数。下列说法不正确的是( )
A. 温度为T时,该反应![]() =64
=64
B. 容器I中在前20min的平均速率v(HI)=0.025molL-1min-1
C. 若起始时,向容器I中加入物质的量均为0.1mol的H2、I2、HI,反应逆向进行
D. 无论x为何值,两容器中达平衡时w(HI)%均相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】六苯乙烷为无色晶体,其结构如图所示。下列有关说法中正确的是( )
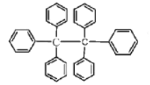
A. 它是一种苯的同系物,易溶于有机溶剂中
B. 它的分子式为C38H30,只含有非极性键
C. 核磁共振氢谱有3组峰
D. 它的分子中所有原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废水中氨态氮以NH3·H2O、NH3和NH4+的形式存在,废水脱氮已成为主要污染物减排和水体富营养化防治的研究热点。
Ⅰ.沉淀法
向废水中投入MgCl2和Na2HPO4,生成MgNH4PO4·6H2O沉淀,可将氨态氮含量降至10mg·L1以下。
(1)NH3的电子式:______。
(2)废水中的NH3·H2O转化为MgNH4PO4·6H2O的离子方程式是______。

(3)16℃时,向废水中加入MgCl2和Na2HPO4,使镁、氮、磷物质的量之比为1︰1︰1,沉淀过程中的pH对剩余氨态氮浓度的影响如图。欲使剩余氨态氮浓度低于10mg·L1,pH的适宜范围是______,pH偏大或者偏小均不利于MgNH4PO4·6H2O的生成。
Ⅱ.微波氧化法
(4)微波协同CuO和H2O2除去氨态氮
①其他条件相同,取相同体积的同一废水样品,微波10 min,剩余氨态氮浓度与一定浓度H2O2溶液添加量的关系如下图。据图推测CuO在氨态氮脱除中可能起催化作用,理由_____________

②微波协同CuO有利于H2O2除去氨态氮。该条件下,H2O2将NH3氧化为N2的化学方程式是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置完成相关实验,合理的是( )
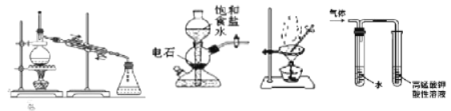
A. 提纯工业乙醇(含甲醇、水等杂质)的装置①
B. 实验室中若需制备较多量的乙炔可用装置②
C. 提纯含苯甲酸钠杂质的粗苯甲酸选择装置③
D. 检验溴乙烷与NaOH乙醇溶液加热制得的气体选择装置④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的表达正确的是( )
A. 原子核内有10个中子的氧原子:![]() O
O
B. 氯原子的结构示意图:![]()
C. Fe3+的最外层电子排布式:3s23p63d5
D. 基态铜原子的外围电子轨道表示式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式和结论之间的关系正确的是( )
A. 常温常压下,1g H2在足量Cl2中燃烧生成HCl放出92.3kJ的热量,则热化学方程式可表示为H2(g)+Cl2(g)=2HCl(g)△H= -184.6kJ
B. 甲烷的燃烧热为890.3kJ·mol-1则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
C. 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3kJ·mol-1,则1molNaOH的稀溶液与足量的稀盐酸完全中和,其中和热为57.3kJ·mol-1
D. 500℃.30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H= -38.6kJ·mol-1
2NH3(g) △H= -38.6kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com