
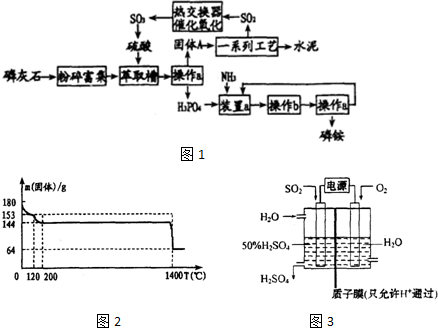
分析 (1)操作a是把固体与液体分开,应为过滤;过滤需要烧杯、漏斗、玻璃棒、铁架台(含铁圈)、滤纸等;操作b是由溶液中析出晶体,应萃取蒸发浓缩、冷却结晶等操作.磷酸受热容易分解,在结晶时应采用低温蒸发结晶;
(2)装置a中磷酸与氨气发生反应,可以生成(NH4)3PO4、(NH4)2HPO4、NH4H2PO4;
(3)①对失水后的晶体进行冷却时必须防止吸水
②200℃加热反应完全失去结晶水得到硫酸钙,1400℃加热硫酸钙,得到能使品红溶液褪色的气体为二氧化硫,S元素化合价降低,则有氧气生成,硫酸钙分解生成氧化钙、二氧化硫与氧气;
③200℃加热反应完全失去结晶水得到硫酸钙,固体减轻质量为180g-144g=36g,为结晶水总质量,由CaSO4•2H2O$\frac{\underline{\;200℃\;}}{\;}$CaSO4+2H2O计算CaSO4•2H2O的质量,进而计算其含量;
(4)阳极发生氧化反应,由电解池示意图可知,二氧化硫在阳极失去电子,氧化得到硫酸.
解答 解:(1)分离固体和液体的方法是过滤;过滤需要盛放药品的烧杯、过滤的漏斗、引流作用的玻璃棒、固定漏斗的铁架台(含铁圈)、滤纸等,此操作需要玻璃仪器:烧杯、漏斗、玻璃棒;
从溶液中析出晶体的方法是:将溶液蒸发浓缩、冷却结晶可得相应晶体,
故答案为:烧杯、漏斗、玻璃棒;蒸发浓缩、冷却结晶;
(2)装置a中磷酸与氨气发生反应,磷酸是三元酸,可以生成(NH4)3PO4、(NH4)2HPO4、NH4H2PO4三种盐,其中(NH4)2HPO4、NH4H2PO4两种酸式盐,
故答案为:(NH4)2HPO4、NH4H2PO4;
(3)①对失水后的晶体进行冷却时必须防止吸水,否则会导致结果有误差,
故答案为:对失水后的晶体进行冷却时必须防止吸水,否则会导致结果有误差;
②200℃加热反应完全失去结晶水得到硫酸钙,1400℃加热硫酸钙,得到能使品红溶液褪色的气体为二氧化硫,S元素化合价降低,则有氧气生成,硫酸钙分解生成氧化钙、二氧化硫与氧气,反应方程式为:2CaSO4$\frac{\underline{\;1400℃\;}}{\;}$2CaO+2SO2↑+O2↑,
故答案为:2CaSO4$\frac{\underline{\;1400℃\;}}{\;}$2CaO+2SO2↑+O2↑;
③200℃加热反应完全失去结晶水得到硫酸钙,固体减轻质量总为180g-144g=36g,为结晶水总质量,
设固体A中含有生石膏的质量为m,则:
CaSO4•2H2O$\frac{\underline{\;200℃\;}}{\;}$CaSO4+2H2O
172 36
m 36g
所以m=$\frac{36g×172}{36}$=172g
所以固体A中生石膏的质量分数=$\frac{172g}{180g}$×100%=95.6%,
故答案为:95.6%;
(4)阳极发生氧化反应,由电解池示意图可知,二氧化硫在阳极失去电子,氧化得到硫酸,阳极电极反应式为:SO2-2e-+2H2O═SO42-+4H+,
故答案为:SO2-2e-+2H2O═SO42-+4H+.
点评 本题比较综合,涉及化学工业流程、化学计算、电解原理应用等,掌握物质的分离方法以及常用实验仪器的用途,侧重考查学生分析和解决问题的能力,难度中等.


 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:解答题
| 序号 | 主要实验步骤及实验现象 |
| ① | 在含Y的溶液中,加入稀硫酸放置,产生浅黄色沉淀和无色有刺激性气味的气体,该气体可使品红溶液褪色 |
| ② | 在含Z的溶液中,滴加盐酸,开始有白色沉淀,继续滴加盐酸,白色沉淀先增加后消失,然后加入过量的氨水又出现白色沉淀 |
| ③ | 将实验②最终得到的混合物加热蒸发、灼烧,最终得到白色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
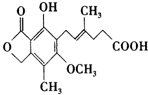 ,下列有关麦考酚酸说法不正确的是( )
,下列有关麦考酚酸说法不正确的是( )| A. | 分子式为C17H20O6 | |
| B. | 能与FeCl3溶液显色,与浓溴水反应,最多消耗量1 mol Br2 | |
| C. | 1mol麦考酚酸最多与3 mol NaOH反应 | |
| D. | 在一定条件下可发生加成,加聚,取代,消去四种反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12C、13C和14C互为同位素,他们的放射性可用于考古断代,可测定生物体死亡的年代 | |
| B. | 合成纤维是利用自然界的纤维材料通过化学合成方法得到的 | |
| C. | 研制出性能优良的催化剂可以使反应的温度降低,从而起到很好的节能效果 | |
| D. | 碰撞理论和过度态理论是常用的化学反应速率理论,其中过渡态理论可解释温度、浓度等对化学反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4、1、5、NO2 | B. | 4、2、4、NO2 | C. | 4、1、3、NH4NO3 | D. | 4、3、5、NO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com