
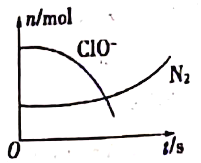
【题目】某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种粒子。其中N2、ClO-的物质的量随时间变化的曲线如图所示。下列判断不正确的是
A. 该反应的氧化剂是ClO-
B. 消耗1mol还原剂,转移3mol电子
C. 氧化剂与还原剂的物质的量之比为2:3
D. 该离子方程式为3ClO-+2NH4+=2H++N2↑+3Cl-+3H2O
【答案】C
【解析】
根据物质的量变化、元素化合价升降确定反应物、生成物,配平离子方程式,并用氧化还原反应知识分析。
据图,ClO-物质的量减少,是反应物;N2物质的量增加,是生成物。因反应前后元素种类不变,得H2O、Cl-是生成物,NH4+是反应物。
A项:ClO-→Cl-,氯元素化合价降低,ClO-是氧化剂,A项正确;
B项:NH4+→N2,氮元素失电子,NH4+是还原剂,消耗1molNH4+时转移3mol电子,B项正确;
C项:据得失电子相等,ClO-和NH4+的消耗量之比为3:2,C项错误;
D项:据以上分析,可写出离子方程式3ClO-+2NH4+=2H++N2↑+3Cl-+3H2O,D项正确。
本题选D。


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。
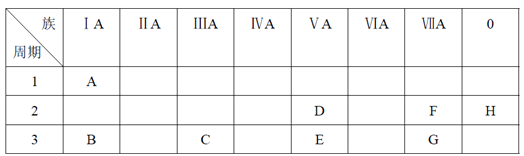
根据A~G元素在周期表中的位置,用化学式填写空白。
(1)氧化性最强的单质是______,还原性最强的单质是______,化学性质最不活泼的单质是______。(填相应的化学式)
(2)最稳定的氢化物是______。(填相应的化学式)
(3)一个E原子的核外电子总共有______种运动状态。
(4)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、E、G四种元素的最高价氧化物对应水化物的化学式排列成序是_______。(填相应的化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在含CH3COOH和CH3COO-的溶液中, CH3COOH、CH3COO-二者中各自所占的物质的量分数(a)随溶液pH变化的关系如图所示。

下列说法不正确的是
A. 在pH<4.76的溶液中,c(CH3COO-)<c(CH3COOH)
B. 在pH=7的溶液中,a(CH3COOH)=0,a(CH3COO-)=1.0
C. 在pH>4.76的溶液中,c(CH3COO-)与c(OH-)之和可大于c(H+)
D. 在pH=4.76的溶液中加盐酸,a(CH3COOH)与a(CH3COO-)之和保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素单质及其化合物是物质世界不可缺少的组成部分。请利用所学物质结构与性质的相关知识回答下列问题:
(1)At原子的核外价电子排布式为______________________;I3+中心原子杂化方式为_______;ClO2-的空间构型为__________。基态氟原子核外电子有________种空间运动状态。
(2)已知高碘酸有两种结构,化学式分别为H5IO6(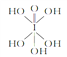 )和HIO4;前者为五元酸,后者为一元酸,请比较二者的酸性强弱:H5IO6 ______HIO4(填“>”、“=”或“<”).
)和HIO4;前者为五元酸,后者为一元酸,请比较二者的酸性强弱:H5IO6 ______HIO4(填“>”、“=”或“<”).
(3)TiCl4熔点为-24℃,沸点为136.4℃。可溶于甲苯,固态TiCl4属于_________晶体。
(4)用锌还原TiCl4的盐酸溶液,可制得绿色配合物[TiCl(H2O)5]Cl2·H2O。1mol该配合物中含有σ键数目为__________。
(5)CaF2晶胞结构如下图
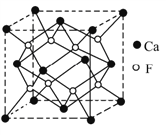
①晶体中距离最近的2个Ca2+(X)与一个F-(Y)形成的夹角(∠XYX)为___________。
②CaF2的摩尔质量为78g/mol,晶胞密度为ρg/cm3,阿伏加德罗常数为NA,则晶体中两个最近的Ca2+间中心距离为____________cm
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是新一代饮用水的消毒剂,我国许多自来水厂采用ClO2代替Cl2来进行自来水消毒。请回答下列有关问题:
(1)ClO2读作____________,它属于________(选填“单质”“氧化物”或“混合物”)。
(2)ClO2中氯元素的化合价为__________。
(3)我国最近成功研制出制取ClO2的新方法,其反应的微观过程如图所示:

该反应的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是不溶于水的液体,常温下不与酸、碱反应,可用如图装置制取(该反应放出热量)。制取时观察到锥形瓶中导管口有白雾出现等现象。下列说法错误的是
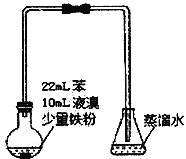
A. 制备溴苯的反应属于取代反应
B. 该反应过程中还可能看到烧瓶中有红色蒸汽
C. 装置图中长直玻璃导管仅起导气作用
D. 溴苯中溶有少量的溴,可用NaOH溶液洗涤除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一定质量的锌粒与1.0L稀盐酸反应(放热反应),生成H2的物质的量与反应时间的关系如图所示,下列结论不正确的是
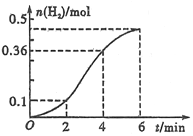
A. 若将锌粒改为锌粉,.可以加快产生H2的反应速率
B. 反应前4 min内温度对反应速率的影响比浓度大
C. 反应前4 min内平均速率v(HC1)=0.18 mol·L-1·min-1
D. 向该反应中加入大量的CuSO4固体,会使生成氢气的速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸镁可用于牙膏、医药和化妆品等工业,化学式为4MgCO3·Mg(OH)2·5H2O,某碱式碳酸镁中含有SiO2杂质,为测定其纯度,某兴趣小组设计了如下几个方案:
方案I取一定质量的样品,与硫酸充分反应,通过测定生成CO2的质量计算纯度

(1)乙中发生反应的方程式为____________。
(2)仪器接口的连接顺序为(装置可以重复使用)a___________,丁的作用是__________。
(3)当样品充分反应完后,缓慢通入空气的目的是:____________。
方案Ⅱ①称取碱式碳酸镁样品mg;②将样品充分高温煅烧,冷却后称量;③重复操作②,测得剩余固体质量为m1g/。
(4)下列仪器中,该方案不会用到的是____________。

(5)判断样品完全分解的方法是_______;本实验至少需要称量_______次。
(6)有同学认为方案Ⅱ高温煅烧的过程中会发生MgCO3 +SiO2![]() MgSiO3 +CO2↑,会导致测定结果有误,你认为这位同学的观点正确吗?______。(填“正确”或“错误”)请说明理由:____________。
MgSiO3 +CO2↑,会导致测定结果有误,你认为这位同学的观点正确吗?______。(填“正确”或“错误”)请说明理由:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com