
【题目】下列有关说法不正确的是(阿伏伽德罗常数为NA)( )
A.氯气跟水反应的离子方程式:Cl2+H2O=2H++Cl-+ClO-
B.15.6克Na2O2中所含的离子总数为0.6NA
C.11克D218O中含有的中子数为6NA
D.![]() 和
和![]() 质子数相同,但属于不同种核素
质子数相同,但属于不同种核素
【答案】A
【解析】
A.HClO是弱酸,据此判断;
B.Na2O2固体由钠离子和过氧根离子构成,据此计算判断;
C.D218O是由2H和18O组成的,据此计算判断;
D.根据核素的概念分析判断。
A.氯气与水反应的化学方程式:Cl2+H2O=HCl+HClO,HClO是弱酸,不能拆,离子方程式为:Cl2+H2O=Cl-+H++HClO,故A错误;
B.15.6 gNa2O2的物质的量为![]() =0.2 mol,Na2O2固体由钠离子和过氧根离子构成,所以0.2 molNa2O2固体中所含有的离子总数为0.6 NA,故B正确;
=0.2 mol,Na2O2固体由钠离子和过氧根离子构成,所以0.2 molNa2O2固体中所含有的离子总数为0.6 NA,故B正确;
C.11g由2H和18O所组成的水的物质的量为![]() =0.5mol,含中子数为:0.5×(10+2×1)×NA=6NA,故C正确;
=0.5mol,含中子数为:0.5×(10+2×1)×NA=6NA,故C正确;
D.![]() 和
和![]() 的质子数相同,中子数不同,互为同位素,是同种元素的不同核素,故D正确;
的质子数相同,中子数不同,互为同位素,是同种元素的不同核素,故D正确;
故选A。


科目:高中化学 来源: 题型:
【题目】CO的催化氧化在消除环境污染、净化空气等方面有重要价值。最新研究发现:常温下CO在Au/BN表面很难被O2氧化,但在H2O的参与下反应很容易发生,转化示意图如图:

下列说法正确的是( )
A.CO2和H2O均只含极性共价键,且为极性分子
B.过程①有氢键形成
C.催化剂可以改变反应的路径,但不会改变反应速率和限度
D.在H2O和Au/BN的共同作用下,CO易被O2氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的解释不正确的是
A.NaHS水溶液显碱性:HS-+H2OS2-+H3O+
B.苯酚能溶于Na2CO3溶液:C6H5OH+CO32-=C6H5O-+HCO3-
C.三元催化剂净化汽车尾气中的NO和CO:2NO+2CO![]() 2CO2+N2
2CO2+N2
D.铜矿淋溶液(CuSO4)遇方铅矿(PbS)发生沉积:Cu2++SO42-+PbS=CuS+PbSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)写出下列物质在水溶液中的电离方程式
NaHSO4___________
(NH4)2CO3_______________
NaHCO3_____________________
(2)现有以下物质:①NaCl溶液 ②干冰 ③ 液态HCl ④铜 ⑤BaSO4固体 ⑥ 蔗糖⑦Na2O ⑧NaOH固体 ⑨盐酸 ⑩NH3
其中能够导电的是__(填序号,下同);属于电解质的是_______;属于非电解质的是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗的值, 已知HCl气体的质量为3.65g
(1)HCl的物质的量为_______________
(2)HCl的分子个数为_______________
(3)原子总数为 _______________
(4)在标准状况的体积为________________
(5)所含电子数为 _________________
(6)如把 HCl完全溶于水配置成1L 溶液,该溶液中H+的物质的量浓度为_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含铬(Ⅵ)废水能诱发致癌,对人类和自然环境有严重的破坏作用。利用Cu2O光催化可以处理含有Cr2O72-的废水。
Ⅰ.制取Cu2O
(1)电解法:利用铜和钛做电极,电解含有NaCl和NaOH的溶液时,反应只消耗了铜和水,体系pH及Cl-浓度维持不变(溶液体积变化忽略不计)。阳极电极反应式是_______。
(2)还原法:控制100℃、pH=5的条件时,利用亚硫酸钠与硫酸铜溶液反应可以制得Cu2O,同时产生SO2气体。反应过程中需要不断地加入烧碱,其原因是_______。
Ⅱ.利用Cu2O光催化处理含Cr2O72-的废水的研究。
(1)光照射到Cu2O光催化剂上产生光催化反应,Cr2O72-和H2O分别在光催化反应中形成的微电极上发生电极反应,反应原理如图所示。写出Cr2O72-转化Cr3+的电极反应:_______。

(2)研究中对Cu2O的作用提出两种假设:
a.Cu2O作光催化剂;b.Cu2O与Cr2O72-发生氧化还原反应。
已知:Cu2O的添加量是2×10-4mol/L,Cr2O72-的初始浓度是1×10-3mol/L;对比实验(pH=3.0且其他条件相同),反应1.5小时结果如图所示。结合试剂用量数据和实验结果可得到的结论是_______,依据是_______。

(3)溶液的pH对Cr2O72-降解率的影响如图所示。

已知:Cu2O![]() Cu+CuSO4;酸性越大,Cr2O72-被还原率越大。
Cu+CuSO4;酸性越大,Cr2O72-被还原率越大。
①pH分别为2、3、4时,Cr2O72-的降解率最好的是___________,其原因是___________。
②已知pH=5时,会产生Cr(OH)3沉淀。pH=5时,Cr2O72-的降解率低的原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组探究KI与Cu(NO3)2的反应,进行实验一:
实验一
注:本实验忽略Cu2+在此条件下的水解。
(1)取棕黄色清液,加入少量______溶液(试剂a),清液变为______色,说明生成了I2。
(2)探究生成I2的原因。
①甲同学进行如下实验:向2mL1mol·L-1KI溶液中加入1mL______溶液(硝酸酸化,pH=1.5),再加入少量试剂a,观察到与(1)相同的现象。甲同学由此得出结论:实验一中生成I2的原因是酸性条件下,![]() 氧化了I-。
氧化了I-。
②乙同学认为仅由甲的实验还不能得出相应结论。他的理由是该实验没有排除____________氧化I-的可能性。
③若要确证实验一中是![]() 氧化了I-,应在实验一的基础上进行检验______的实验。
氧化了I-,应在实验一的基础上进行检验______的实验。
(3)探究棕黑色沉淀的组成。
①查阅资料得知:CuI为难溶于水的白色固体。于是对棕黑色沉淀的组成提出两种假设:
a.CuI吸附I2b._________吸附I2。为证明上述假设是否成立,取棕黑色沉淀进行实验二:
实验二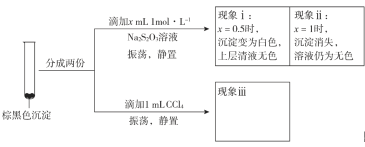
已知:CuI难溶于CCl4;I2+![]() ==2I-+
==2I-+![]() (无色);Cu++S2O32-==
(无色);Cu++S2O32-==![]() (无色)。由实验二得出结论:棕黑色沉淀是CuI吸附I2形成的。
(无色)。由实验二得出结论:棕黑色沉淀是CuI吸附I2形成的。
②现象iii为______________。
③用化学平衡移动原理解释产生现象ii的原因:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素单质在碱性溶液中容易发生歧化反应,歧化的产物依反应温度的不同而不同。
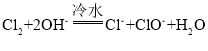 、
、![]()
下图为制取氯气、氯酸钾、次氯酸钠和检验氯气性质的微型实验装置:
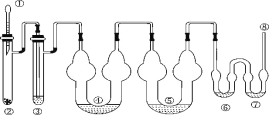
装置中盛装的药品如下:
①胶头滴管中装有 5 mL 浓盐酸;②微型具支试管中装有 1.5 g KMnO4;③微型具支试管中装有 2~3 mL 浓硫酸;④U 形反应管中装有 30% KOH 溶液;⑤U 形反应管中装有 2 mol·L-1 NaOH 溶液;⑥、⑦双 U 形反应管中分别装有 0.1 mol·L-1 KI-淀粉溶液和 KBr 溶液;⑧尾气出口用浸有 0.5 mol·L-1 Na2S2O3 溶液的棉花轻轻覆盖住
(1)检查整套装置气密性的方法是_________。
(2)为了使装置④⑤中的反应顺利完成,应该控制的反应条件分别为_______、_______。
(3)装置⑥⑦中能够观察到的实验现象分别是_________, _______。
(4)如果把装置⑥⑦中的试剂互换位置,则______(填“能”或“不能”)证明氧化性 Cl2>I2,理由是________。
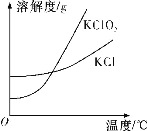
(5)已知氯酸钾和氯化钾的溶解度曲线如图所示,反应结束后,从装置④所得溶液中提取氯酸钾晶体的实验操作是________。
(6)尾气处理时 Cl2 发生反应的离子方程式为_________。
(7)选择微型实验装置的优点有____________(任答两点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铂、钴、镍及其化合物在工业和医药等领域有重要应用。回答下列问题:
(1)筑波材料科学国家实验室科研小组发现了在5K下呈现超导性的晶体CoO2,该晶体具有层状结构。
①晶体中原子Co与O的配位数之比为_________。
②基态钴原子的价电子排布图为_______。
(2)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于_____晶体;写出两种与CO具有相同空间构型和键合形式的分子或离子:_______。
(3)某镍配合物结构如图所示:
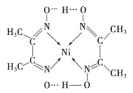
①分子内含有的化学键有___________(填序号).
A 氢键 B 离子键 C 共价键 D 金属键 E 配位键
②配合物中C、N、O三种元素原子的第一电离能由大到小的顺序是N> O>C,试从原子结构解释为什么同周期元素原子的第一电离能N>O_________。
(4)某研究小组将平面型的铂配合物分子进行层状堆砌,使每个分子中的铂原子在某一方向上排列成行,构成能导电的“分子金属" ,其结构如图所示。
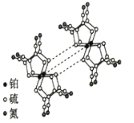
①"分子金属"可以导电,是因为______能沿着其中的金属原子链流动。
②"分子金属"中,铂原子是否以sp3的方式杂化?_________(填“是"或“否"),其理由是__________。
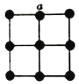
(5)金属铂晶体中,铂原子的配位数为12,其立方晶胞沿x、y或z轴的投影图如图所示,若金属铂的密度为d g·cm-3,则晶胞参数a=_______nm(列计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com