
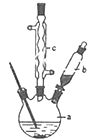
 ±½ŅŅĖįĶŹĒŗĻ³ÉÓÅĮ¼“߻ƼĮ”¢“«øŠ²ÄĮĻ--ÄÉĆ×Ńõ»ÆĶµÄÖŲŅŖĒ°ĒżĢåÖ®Ņ»£¬ĻĀĆęŹĒĖüµÄŅ»ÖÖŹµŃéŹŅŗĻ³ÉĀ·Ļߣŗ
±½ŅŅĖįĶŹĒŗĻ³ÉÓÅĮ¼“߻ƼĮ”¢“«øŠ²ÄĮĻ--ÄÉĆ×Ńõ»ÆĶµÄÖŲŅŖĒ°ĒżĢåÖ®Ņ»£¬ĻĀĆęŹĒĖüµÄŅ»ÖÖŹµŃéŹŅŗĻ³ÉĀ·Ļߣŗ
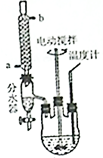
·ÖĪö £Ø1£©ÅäÖĘ“ĖĮņĖįŹ±£¬Ó¦½«ĆܶȓóµÄ×¢ČėĆܶȊ”µÄŅŗĢåÖŠ£¬·ĄÖ¹»ģŗĻŹ±·Å³öČČŹ¹ŅŗµĪ·É½¦£»
£Ø2£©ÓÉĶ¼æÉÖŖ£¬cĪŖĄäÄż¹Ü£¬Ź¹Ęų»ÆµÄŅŗĢåĄäÄż»ŲĮ÷£¬ŅĒĘ÷bæɼÓČė·“Ó¦Ņŗ£»·“Ó¦½įŹųŗó¼ÓŹŹĮæĄäĖ®£¬½µµĶĪĀ¶Č£¬¼õŠ”±½ŅŅĖįµÄČܽā¶Č£»·ÖĄė±½ŅŅĖį“ÖĘ·£¬ĄūÓĆ¹żĀĖ²Ł×÷£»
£Ø3£©±½ŅŅĖįĪ¢ČÜÓŚĄäĖ®£¬ŌŚĖ®ÖŠµÄČܽā¶Č½ĻŠ”£»ÓÉ·“Ó¦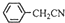 +H2O+H2SO4 $\stackrel{100”«130”ę}{”ś}$
+H2O+H2SO4 $\stackrel{100”«130”ę}{”ś}$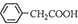 +NH4HSO4æÉÖŖ£¬40g±½ŅŅėęÉś³É±½ŅŅĖįĪŖ40g”Į$\frac{136}{117}$=46.5g£»
+NH4HSO4æÉÖŖ£¬40g±½ŅŅėęÉś³É±½ŅŅĖįĪŖ40g”Į$\frac{136}{117}$=46.5g£»
£Ø4£©ÓĆÕōĮóĖ®Ļ“µÓ³Įµķ£¬½«ĀČĄė×ÓĻ“µÓøɾ»£¬ĄūÓĆĻõĖįŅų¼ģŃéĻ“µÓŅŗČ·¶ØŹĒ·ńĻ“µÓøɾ»£»
£Ø5£©±½ŅŅĖįĪ¢ČÜÓŚĄäĖ®£¬ČÜÓŚŅŅ“¼£¬»ģŗĻČܼĮÖŠŅŅ“¼æÉŌö“ó±½ŅŅĖįµÄČܽā¶Č£®
½ā“š ½ā£ŗ£Ø1£©Ļ”ŹĶÅØĮņĖį·Å³ö“óĮæµÄČČ£¬ÅäÖĘ“ĖĮņĖįŹ±£¬Ó¦½«ĆܶȓóµÄ×¢ČėĆܶȊ”µÄŅŗĢåÖŠ£¬·ĄÖ¹»ģŗĻŹ±·Å³öČČŹ¹ŅŗµĪ·É½¦£¬Ōņ¼ÓČėÕōĮóĖ®ÓėÅØĮņĖįµÄĻČŗóĖ³ŠņŹĒĻČ¼ÓĖ®”¢ŌŁ¼ÓČėÅØĮņĖį£¬
¹Ź“š°øĪŖ£ŗĻČ¼ÓĖ®”¢ŌŁ¼ÓČėÅØĮņĖį£»
£Ø2£©ÓÉĶ¼æÉÖŖ£¬cĪŖĒņŠĪĄäÄż¹Ü£¬Ęä×÷ÓĆĪŖ»ŲĮ÷£Ø»ņŹ¹Ęų»ÆµÄ·“Ó¦ŅŗĄäÄż£©£¬ŅĒĘ÷bµÄ×÷ÓĆĪŖµĪ¼Ó±½ŅŅėę£»·“Ó¦½įŹųŗó¼ÓŹŹĮæĄäĖ®£¬½µµĶĪĀ¶Č£¬¼õŠ”±½ŅŅĖįµÄČܽā¶Č£¬Ōņ¼ÓČėĄäĖ®æɱćÓŚ±½ŅŅĖįĪö³ö£»·ÖĄė±½ŅŅĖį“ÖĘ·£¬ĄūÓĆ¹żĀĖ²Ł×÷£¬ŌņŠčŅŖµÄŅĒĘ÷ĪŖĀ©¶·”¢ÉÕ±”¢²£Į§°ō£¬¹ŹŃ”BCE£¬
¹Ź“š°øĪŖ£ŗµĪ¼Ó±½ŅŅėę£»ĒņŠĪĄäÄż¹Ü£»»ŲĮ÷£Ø»ņŹ¹Ęų»ÆµÄ·“Ó¦ŅŗĄäÄż£©£»±ćÓŚ±½ŅŅĖįĪö³ö£»BCE£»
£Ø3£©±½ŅŅĖįĪ¢ČÜÓŚĄäĖ®£¬ŌŚĖ®ÖŠµÄČܽā¶Č½ĻŠ”£¬ŌņĢį“æ±½ŅŅĖįµÄ·½·ØŹĒÖŲ½į¾§£»ÓÉ·“Ó¦ +H2O+H2SO4 $\stackrel{100”«130”ę}{”ś}$
+H2O+H2SO4 $\stackrel{100”«130”ę}{”ś}$ +NH4HSO4æÉÖŖ£¬40g±½ŅŅėęÉś³É±½ŅŅĖįĪŖ40g”Į$\frac{136}{117}$=46.5g£¬×īÖÕµĆµ½44g“æĘ·£¬Ōņ±½ŅŅĖįµÄ²śĀŹŹĒ$\frac{44g}{46.5g}$”Į100%=95%£¬
+NH4HSO4æÉÖŖ£¬40g±½ŅŅėęÉś³É±½ŅŅĖįĪŖ40g”Į$\frac{136}{117}$=46.5g£¬×īÖÕµĆµ½44g“æĘ·£¬Ōņ±½ŅŅĖįµÄ²śĀŹŹĒ$\frac{44g}{46.5g}$”Į100%=95%£¬
¹Ź“š°øĪŖ£ŗÖŲ½į¾§£»95%£»
£Ø4£©ÓĆÕōĮóĖ®Ļ“µÓ³Įµķ£¬½«ĀČĄė×ÓĻ“µÓøɾ»£¬ĄūÓĆĻõĖįŅų¼ģŃéĻ“µÓŅŗČ·¶ØŹĒ·ńĻ“µÓøɾ»£¬Ōņ³ĮµķĻ“øɾ»µÄŹµŃé²Ł×÷ŗĶĻÖĻóŹĒČ”×īŗóŅ»“ĪÉŁĮæĻ“µÓŅŗ£¬¼ÓČėĻ”ĻõĖį£¬ŌŁ¼ÓČėAgNO3ČÜŅŗ£¬ĪŽ°×É«»ė×Ē³öĻÖ£¬
¹Ź“š°øĪŖ£ŗČ”×īŗóŅ»“ĪÉŁĮæĻ“µÓŅŗ£¬¼ÓČėĻ”ĻõĖį£¬ŌŁ¼ÓČėAgNO3ČÜŅŗ£¬ĪŽ°×É«»ė×Ē³öĻÖ£»
£Ø5£©±½ŅŅĖįĪ¢ČÜÓŚĄäĖ®£¬ČÜÓŚŅŅ“¼£¬»ģŗĻČܼĮÖŠŅŅ“¼æÉŌö“ó±½ŅŅĖįµÄČܽā¶Č£¬Č»ŗóÓėCu£ØOH£©2·“Ó¦³żČ„±½ŅŅĖį£¬¼“»ģŗĻČܼĮÖŠŅŅ“¼µÄ×÷ÓĆŹĒŌö“ó±½ŅŅĖįČܽā¶Č£¬±ćÓŚ³ä·Ö·“Ó¦£¬
¹Ź“š°øĪŖ£ŗŌö“ó±½ŅŅĖįČܽā¶Č£¬±ćÓŚ³ä·Ö·“Ó¦£®
µćĘĄ ±¾Ģā²ąÖŲĪļÖŹÖʱøŹµŃé¼°ÓŠ»śĪļŠŌÖŹµÄ漲飬°ŃĪÕŗĻ³É·“Ó¦¼°ŹµŃé×°ÖƵÄ×÷ÓĆĪŖ½ā“šµÄ¹Ų¼ü£¬×ŪŗĻæ¼²éѧɜŹµŃé¼¼ÄÜŗĶ·ÖĪö½ā“šĪŹĢāµÄÄÜĮ¦£¬ĢāÄæÄѶČÖŠµČ£¬×¢ŅāŠÅĻ¢µÄ“¦Ąķ¼°Ó¦ÓĆ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ³ĪĒåµÄŹÆ»ŅĖ®ÓėĻ”ŃĪĖį·“Ó¦ Ca£ØOH£©2+2H+=Ca2++2H2O | |
| B£® | ĻņĻõĖįŅųČÜŅŗÖŠ¼ÓŃĪĖį£ŗAg++C1-ØTAgCl”ż | |
| C£® | Ķʬ²åČėĻõĖįŅųČÜŅŗÖŠ Cu+Ag+=Cu2++Ag | |
| D£® | ĒāŃõ»Æ±µČÜŅŗÓėĮņĖįµÄ·“Ó¦ OH-+H+=H2O |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 Ä³Ń§Ļ°Š”×éŅŌŅŅ¶žĖį£Ø·Ö×ÓŹ½£ŗH2C2O4£¬½į¹¹¼ņŹ½£ŗHOOC-COOH£¬¶žŌŖČõĖį£¬Ė×³Ę²ŻĖį£©ŗĶŅŅ“¼ĪŖŌĮĻÖʱøŅŅ¶žĖį¶žŅŅõ„£¬ŹµŃé²½ÖčČēĻĀ£ŗ
Ä³Ń§Ļ°Š”×éŅŌŅŅ¶žĖį£Ø·Ö×ÓŹ½£ŗH2C2O4£¬½į¹¹¼ņŹ½£ŗHOOC-COOH£¬¶žŌŖČõĖį£¬Ė×³Ę²ŻĖį£©ŗĶŅŅ“¼ĪŖŌĮĻÖʱøŅŅ¶žĖį¶žŅŅõ„£¬ŹµŃé²½ÖčČēĻĀ£ŗ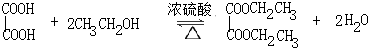 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
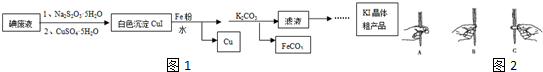
 Ä³ŃŠ¾æŠŌѧĻ°Š”×éĒėÄć²ĪÓė”°ŃŠ¾æĢśÓėĖ®·“Ó¦ĖłµĆ¹ĢĢåĪļÖŹµÄ³É·Ö”¢ŠŌÖŹ¼°ŌŁĄūÓĆ”±ŹµŃéĢ½¾æ£¬²¢¹²Ķ¬½ā“šĻĀĮŠĪŹĢā£ŗ
Ä³ŃŠ¾æŠŌѧĻ°Š”×éĒėÄć²ĪÓė”°ŃŠ¾æĢśÓėĖ®·“Ó¦ĖłµĆ¹ĢĢåĪļÖŹµÄ³É·Ö”¢ŠŌÖŹ¼°ŌŁĄūÓĆ”±ŹµŃéĢ½¾æ£¬²¢¹²Ķ¬½ā“šĻĀĮŠĪŹĢā£ŗ²éæ““š°øŗĶ½āĪö>>
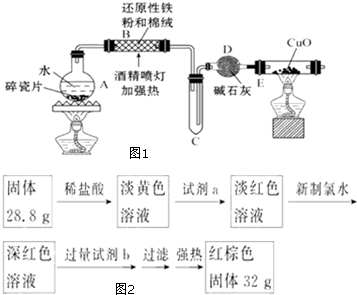
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ŹµŃé×é | ĪĀ¶Č/”ę | ĘšŹ¼Įæ/mol | Ę½ŗāĮæ/mol | “ļĘ½ŗāĖłŠčŹ±¼ä/min | ||
| C | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | ” | 6 |
| 2 | 900 | 6 | 3 | ” | 1.5 | 3 |
| 3 | 900 | ” | ” | ” | ” | 1 |
²éæ““š°øŗĶ½āĪö>>
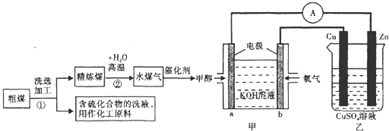
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| ŹµŃé | ĪĀ¶Č/”ę | ĘšŹ¼Ź± | Ę½ŗāŹ± | |||
| n£ØCO£©/mol | n£ØH2S£©/mol | n£ØCOS£©/mol | n£ØH2£©/mol | n£ØCO£©/mol | ||
| 1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
| 2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | a |
| 3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
| A£® | ÉĻŹö·“Ó¦ŹĒĪüČČ·“Ó¦ | |
| B£® | ŹµŃé1 “ļĘ½ŗāŹ±£¬CO µÄ×Ŗ»ÆĀŹĪŖ70% | |
| C£® | ŹµŃé2 “ļĘ½ŗāŹ±£¬a£¼7.0 | |
| D£® | ŹµŃé3 “ļĘ½ŗāŗó£¬ŌŁ³äČė1.0molH2£¬K ÖµŌö“ó£¬Ę½ŗāÄęĻņŅĘ¶Æ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com