
【题目】硫代硫酸钠俗称大苏打、海波,主要用作照相业定影剂,还广泛应用于鞣革、媒染、化工、医药等行业。常温下,溶液中析出晶体为Na2S2O35H2O.Na2S2O35H2O于40-45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如图甲所示。

Ⅰ.制备Na2S2O35H2O
将硫化钠和碳酸钠按反应要求比例放入图乙装置D中,然后注入150mL蒸馏水使其溶解,再在分液漏斗A中注入一定浓度的H2SO4,在蒸馏烧瓶B中加入亚硫酸钠固体,并按图乙安装好装置。
(1)仪器D的名称为______
(2)打开分液漏斗活塞,注入H2SO4,使反应产生的气体较缓慢均匀地通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,总反应方程式为2Na2S+Na2CO3+4SO2 ![]() 3Na2S2O3+CO2。
3Na2S2O3+CO2。
①烧瓶B中发生反应的化学方程式为______。
②将B中产生的气体缓慢均匀地通入D中的正确操作是______。
③制备过程中仪器D中的溶液要控制在弱碱性条件下,其理由是______(用离子方程式表示)。
Ⅱ.分离Na2S2O35H2O并测定含量

(3)操作I为趁热过滤,其目的是______;操作Ⅱ是过滤、洗涤、干燥,其中洗涤操作时用______(填试剂)作洗涤剂。
(4)蒸发浓缩滤液直至溶液中有少量晶体析出为止,蒸发时控制温度不宜过高的原因是______。
(5)制得的粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O35H2O的含量,称取1.25g的粗样品溶于水,配成250mL溶液,取25.00mL溶液于锥形瓶中,滴入几滴淀粉溶液,用0.0100mol/L标准I2溶液滴定,当溶液中S2O32-全部被氧化时,消耗碘溶液的体积为25.00mL.试回答:(提示:I2+2S2O32-═2I-+S4O62-)
①达到滴定终点时的现象:______
②产品中Na2S2O35H2O的质量分数为______。
【答案】三颈烧瓶 Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O 观察仪器D中气体的流速,控制分液漏斗A的旋塞,控制产生气体的速度 S2O32-+2H+═S↓+SO2↑+H2O 防止硫代硫酸钠晶体析出 乙醇 避免析出的晶体Na2S2O35H2O因温度过高而分解 滴加最后一滴标准I2溶液时溶液由无色变为蓝色且半分钟内不变色,说明到达滴定终点 99.2%
【解析】
(1)根据仪器的构造可知,仪器D的名称为三颈烧瓶,故答案为:三颈烧瓶;
(2)①亚硫酸钠与浓硫酸反应生成二氧化硫气体,反应的化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,故答案为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
②为将B中产生的气体缓慢均匀地通入D中,可以观察仪器D中气体的流速,通过控制分液漏斗A的旋塞,可控制产生气体的速度,故答案为:观察仪器D中气体的流速,控制分液漏斗A的旋塞,控制产生气体的速度;
③Na2S2O3在酸性条件下会生成S和SO2,所以制备过程中仪器D中的溶液要控制在弱碱性条件下以防止Na2S2O3发生歧化反应,其离子方程式为:S2O32-+2H+=S↓+SO2↑+H2O,故答案为:S2O32-+2H+=S↓+SO2↑+H2O;
(3)根据图甲可知,温度低时,硫代硫酸钠的溶解度小,会结晶析出,所以需要趁热过滤,防止硫代硫酸钠晶体析出;Na2S2O3易溶于水,不溶于乙醇,所以为防止洗涤损失硫代硫酸钠,应该用乙醇作洗涤剂,故答案为:防止硫代硫酸钠晶体析出;乙醇;
(4)Na2S2O35H2O于40-45℃熔化,48℃分解,所以蒸发时控制温度不宜过高的原因是避免析出的晶体Na2S2O35H2O因温度过高而分解,故答案为:避免析出的晶体Na2S2O35H2O因温度过高而分解;
(5)①碘遇淀粉变蓝色,反应结束时,溶液中S2O32-全部被氧化时,滴加最后一滴标准I2溶液时溶液由无色变为蓝色且半分钟内不变色,说明到达滴定终点,故答案为:滴加最后一滴标准I2溶液时,溶液由无色变为蓝色且半分钟内不变色,说明到达滴定终点;
②根据碘与硫代硫酸钠的反应I2+2S2O32-═2I-+S4O62-中的比例关系,配成的溶液中 c(S2O32-)= ![]() =
= ![]() =0.02mol/L,则产品中Na2S2O35H2O的质量分数=
=0.02mol/L,则产品中Na2S2O35H2O的质量分数=![]() =99.2%,故答案为:99.2%。
=99.2%,故答案为:99.2%。


科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,下列叙述不正确的是( )
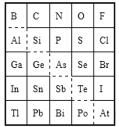
A.Pb的最高正价为+4B.原子半径比较:Al>F
C.酸性强弱:H3AsO4<H2SeO4D.Br的最高价氧化物对应水化物的化学式为HBrO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外兴趣小组为探究足量的铜跟浓硫酸的反应情况,用下图所示装置进行有关实验。
已知:①SO2难溶于饱和亚硫酸氢钠溶液。②SO2能与酸性高锰酸钾溶液发生氧化还原反应。请回答下列问题:

(1)装置A中发生的化学反应方程式为____________;此反应表明浓硫酸具有_________(填字母)。
a. 酸性 b. 脱水性 c. 强氧化性 d. 吸水性
(2)装置D中试管口放置的棉花中浸入__________溶液,其作用是_____________。
(3)装置B的作用是贮存多余的气体,B中应放置的液体是__________(填字母)。
a. 水 b. 饱和NaHSO3溶液 c. 酸性KMnO4溶液 d. NaOH溶液
(4)实验中,取一定质量的铜片和一定体积18.4 mol·L-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是____________。
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是___________(填字母)。
a. 银粉 b. 铁粉 c. BaCl2溶液 d. NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t ℃时将a g NH3完全溶于水得到V mL溶液,该溶液的密度为ρg·cm-3,质量分数为w。下列说法正确的是
A. 溶质的质量分数w=a/(Vρ-a)×100%
B. 溶质的物质的量浓度c= a/17V mol·L-1
C. 溶液密度ρ可表示为 17c/w g·cm-3
D. 上述溶液中再加入V mL水,所得溶液溶质的质量分数小于0.5w
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用KOH为电解质的循环阳极锌空气二次电池放电时的总反应为2Zn+O2=2ZnO,工作时,用泵将锌粉与电解液形成的浆料输入电池内部发生反应,反应所生成的产物随浆料流出电池后,被送至电池外部的电解槽中,经还原处理后再送入电池;循环阳极锌-空气二次电池工作流程图如图所示。下列说法错误的是( )
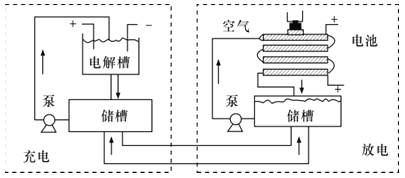
A.放电时,电池正极反应为O2+4e-+2H2O=4OH-
B.放电时,电解质中会生成少量碳酸盐
C.电池停止工作时,锌粉与电解质溶液不反应
D.充电时,电解槽阴极反应为ZnO+2e-+H2O=Zn+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白色固体混合物A,含有KCl、CaCO3、Na2CO3、Na2SiO3、CuSO4中的几种,常温常压下进行如下实验。
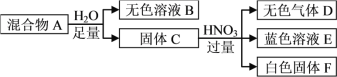
下列推断不正确的是
A. 无色溶液B的pH≥7
B. 白色固体F的主要成分是H2SiO3
C. 混合物A中有Na2SiO3、CuSO4和CaCO3
D. 在无色溶液B中加HNO3酸化,无沉淀;再滴加AgNO3,若有白色沉淀生成,说明混合物A中有KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼单质在高温时是良好的导体,也是用途广泛的化工原料。镁单质可用于制造轻金属合金、球墨铸铁等。硼镁矿的主要成分为Mg2B2O5·H2O,可以制取单质硼和镁。制取工艺流程如图所示,已知硼砂的化学式为Na2B4O7·10H2O,硼镁泥是硼镁矿制硼砂过程中产生的废渣,其主要成分是MgCO3,还含有CaO、Al2O3、Fe2O3、FeO、MnO、SiO2等杂质。按要求回答问题:
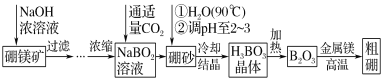

(1)化合物Mg2B2O5·H2O中B的化合价为_____。
(2)将硼砂溶于热水后,常用稀硫酸调pH至2~3制取H3BO3,该反应的离子方程式为____。
(3)写出加NaClO的过程中发生反应的离子方程式:________;________。
(4)将硼镁泥中加入的硫酸改为盐酸是否可行?___。(填“是”或“否”),理由是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】40℃时,在氨—水体系中不断通入CO2,各种粒子的浓度变化趋势如图所示。下列说法不正确的是
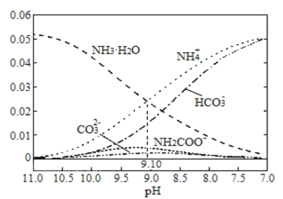
A.40℃时,K(NH3·H2O)=10-9.10
B.不同pH的溶液中均存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-)
C.随着CO2的通入,![]() 不断减小
不断减小
D.随溶液pH不断降低,生成的中间产物NH2COONH4又不断转化为NH4HCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质检验是化学研究常用的方法之一。下列说法正确的是
A.若滴加硝酸银溶液,产生白色沉淀,则原溶液一定含Cl-
B.若滴加碳酸钠溶液,产生白色沉淀,则原溶液一定含Ca2+
C.若滴加硫氰化钾溶液,无明显变化,再滴入氯水溶液变红,则原溶液一定含Fe2+
D.若滴加稀盐酸,产生能使澄清石灰水变浑浊的气体,则原溶液一定含CO![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com