
| A. | 该物质有三种官能团,该物质自身能发生酯化反应 | |
| B. | 该物质能使酸性高锰酸钾溶液和溴水褪色,它们的反应原理相同 | |
| C. | 该物质能通过两种方式的反应生成两种高分子物质 | |
| D. | 1mol该物质能够消耗2mol金属钠同时放出1mol氢气 |
分析 有机物含有羧基,可发生中和、酯化反应,含有羟基,可发生取代、氧化反应,含有碳碳双键,可发生加成、加聚和氧化反应,以此解答该题.
解答 解:A.含有羧基、碳碳双键、羟基三种官能团,可自身发生酯化反应,故A正确;
B.含有碳碳双键,可被高锰酸钾氧化,与溴水发生加成反应,原理不同,故B错误;
C.含有碳碳双键,可发生加聚反应,含有羧基、羟基,可发生缩聚反应,故C正确;
D.含有羧基、羟基,则1mol该物质能够消耗2mol金属钠同时放出1mol氢气,故D正确.
故选B.
点评 本题考查有机物的结构和性质,侧重考查官能团的判断、物质的性质等知识点,为高考常见题型,难度不大,结构决定性质,性质体现结构,熟记官能团的性质是解题的关键,


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小:Z>X>Y | |
| B. | Z的氢化物的沸点一定比X 的低 | |
| C. | W的最高价氧化物对应水化物的酸性在同主族中最强 | |
| D. | Y的单质与Z、X形成的化合物反应可冶炼金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |||
| n(X) | n(Y) | n(M) | n(N) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0 | 0 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0 | 0 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | 0.25 | 0.25 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:NH3>PH3>AsH3 | B. | 熔点:Li>Na>K>Rb>Cs | ||
| C. | 酸性:HClO4>H2SO4>H2SeO4 | D. | 碱性:KOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
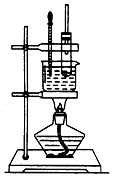 实验室制备硝基苯的实验装置如图所示,填写下列空白:
实验室制备硝基苯的实验装置如图所示,填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 元素代号 | A | B | C | D | E | F | G |
| 原子半径/nm | 0.182 | 0.160 | 0.089 | 0.143 | 0.102 | 0.099 | 0.071 |
| 主要化合价 | +1 | +2 | +2 | +3 | +6.-2 | -1 | -1 |
| A. | 气态氢化物的稳定性HG>HF>H2E | |
| B. | B2+、D3+、E2-、G-四种离子的核外电子排布相同 | |
| C. | A、E元素与氧元素可以形成三种常见的含氧酸盐 | |
| D. | C元素的原子最外层电子数等于电子层数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2CO3溶液中通入NH3,$\frac{c(N{a}^{+})}{c(C{{O}_{3}}^{2-})}$减小 | |
| B. | 将0.1mol•L-1的K2C2O4溶液从25℃升温至35℃,$\frac{c({K}^{+})}{c({C}_{2}{{O}_{4}}^{2-})}$增大 | |
| C. | 向0.1mol•L-1的HF溶液中滴加NaOH溶液至中性,$\frac{c(N{a}^{+})}{c({F}^{-})}$=1 | |
| D. | 向0.1mol•L-1的CH3COONa溶液中加入少量水,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}$增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com