
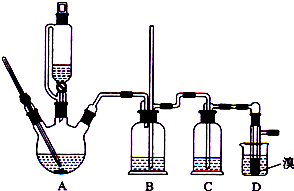
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
分析 (1)三颈烧瓶A中发生反应是乙醇在浓硫酸的作用下加热到170℃产生乙烯;乙烯分子含有C=C双键,能与溴发生加成反应,D中发生乙烯与溴单质反应生成1,2-二溴乙烷;
(2)乙醇在浓硫酸140℃的条件下,发生分子内脱水生成乙醚;
(3)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳;生成的酸性气体为SO2、CO2可以和氢氧化钠反应;
(4)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色;
(5)1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大;
(6)因Br2能与NaOH溶液反应,且1,2-二溴乙烷与水互不相溶,所以用氢氧化钠溶液吸收Br2,采用的仪器是分液漏斗.
(7)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离;
(8)溴易挥发,冷却防止溴大量挥发;1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
解答 解:(1)三颈烧瓶A中发生反应是乙醇在浓硫酸的作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,反应方程式为:CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,乙烯含有不饱和键C=C双键,能卤素单质发生加成反应,D中乙烯和溴加成生成1,2-二溴乙烷,反应为:CH2=CH2+Br-Br→CH2Br-CH2Br,
故答案为:CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O、CH2=CH2+Br-Br→CH2Br-CH2Br;
(2)乙醇在浓硫酸140℃的条件下,发生分子内脱水生成乙醚,可能迅速地把反应温度提高到170℃左右,其最主要目的是:减少副产物乙醚生成;
故答案为:d;
(3)浓硫酸具有脱水性、吸水性和强氧化性,能氧化乙醇,CH3CH2OH+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4SO2↑+CO2↑+7H2O+C,可能生成的酸性气体为二氧化硫、二氧化碳,二氧化碳在水中溶解度小,高锰酸钾不能吸收二氧化碳,浓硫酸既不能吸收二氧化碳,也不能吸收二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应:SO2+2NaOH=Na2SO3+H2O,CO2+2NaOH═Na2CO3+H2O,
故答案为:c;
(4)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色,D中溴颜色完全褪去说明反应已经结束,
故答案为:溴的颜色完全褪去;
(5)1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大,有机层在下层,
故答案为:下;
(6)a.溴更易溶液1,2-二溴乙烷,用水无法除去溴,故a错误;
b.常温下Br2和氢氧化钠发生反应:2NaOH+Br2═NaBr+NaBrO+H2O,再分液除去,故b正确;
c.NaI与溴反应生成碘,碘与1,2-二溴乙烷互溶,不能分离,故c错误;
d.酒精与1,2-二溴乙烷互溶,不能除去混有的溴,故d错误,
故答案为:b.
(7)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离,
故答案为:蒸馏;
(8)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却,过度冷却会使其凝固而使气路堵塞,导致B中长导管内液面上升,
故答案为:冷却可避免溴的大量挥发;产品1,2-二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管.
点评 本题考查制备实验方案的设计,为高频考点,把握制备实验原理、混合物分离提纯实验等为解答的关键,侧重分析与实验能力的考查,题目难度中等.


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:解答题
 新型纳米材料a-Fe粉末具有超强磁性,可用作高密度磁记录的介质和高效催化剂等.某校化学小组学生利用如图所示装置进行探究实验,已知该校实验室的酒精灯火焰的温度约为500℃.
新型纳米材料a-Fe粉末具有超强磁性,可用作高密度磁记录的介质和高效催化剂等.某校化学小组学生利用如图所示装置进行探究实验,已知该校实验室的酒精灯火焰的温度约为500℃.| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 取少量反应后的黑色粉末X,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;产生少量气泡 |
| Ⅱ | 向实验I中得到的溶液滴加2滴KSCN溶液,振荡 | 溶液没有出现红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 20.10 |
| 2 | 1.00 | 20.90 |
| 3 | 0.00 | 21.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:| 化合物 | 相对分 子质量 | 密度 /(g•cm-3) | 沸点/℃ | 溶解度 /(g/100g水) |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度c(甲)=10c(乙) | |
| B. | 甲中由水电离产生的H+的物质的量浓度和乙的相等 | |
| C. | 中和等物质的量浓度等体积的NaOH溶液需甲、乙两酸的体积V(乙)>10V(甲) | |
| D. | 甲中的c(OH-)为乙中c(OH-)的10倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com