
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是 ( )

A. 正极反应中有CO2生成
B. 微生物促进了反应中电子的转移
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2===6CO2+6H2O
【答案】A
【解析】试题分析:首先根据原电池反应判断出厌氧反应为负极侧,有氧反应为正极侧。A、根据厌氧反应中碳元素的化合价的变化:葡萄糖分子中碳元素平均为0价,二氧化碳中碳元素的化合价为+4价,所以生成二氧化碳的反应为氧化反应,所以在负极生成,A正确;B、在微生物的作用下,该装置为原电池装置。原电池能加快氧化还原反应速率,故可以说微生物促进了电子的转移,B正确;C、原电池中阳离子向正极移动,即质子通过交换膜从负极区移向正极区,C正确;D、正极是氧气得到电子结合氢离子生成水,即O2+4e-+4H+=2H2O,D错误,答案选D。
【名师点晴】该题是高频考点,侧重于电化学原理的应用。电化学包括原电池和电解池。原电池是将化学能转化为电能的装置,组成有正负极、电解质溶液、形成闭合回路,活动性强的电极为负极,发生氧化反应,活动性弱的电极为正极,正极上发生还原反应。电解池是将电能转化为化学能的装置。与外加电源正极连接的为阳极,与电源负极连接的为阴极。阳极发生氧化反应,阴极发生还原反应。若阳极是活性电极,则是电极本身失去电子,若电极是惰性电极,则电解质溶液(或熔融状态)阴离子发生还原反应。掌握好阴离子、阳离子的放电顺序、清楚在闭合回路中电子转移数目相等是本题的关键。特别是要注意溶液的酸碱性,有无质子交换膜等。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某温度下,在密闭容器中SO2、O2、SO3三种气态物质建立化学平衡后,改变条件对反应2SO2(g)+O2(g)2SO3(g),△H<0的正、逆反应速率的影响如图所示: 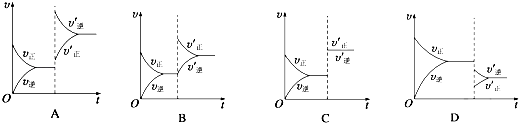
(1)加催化剂对反应速率影响的图像是(填序号,下同),平衡移动.
(2)升高温度对反应速率影响的图像是 , 平衡向方向移动.
(3)增大反应容器体积对反应速率影响的图像是 , 平衡向方向移动.
(4)增大O2的浓度对反应速率影响的图像是 , 平衡向方向移动.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,模拟工业电解法来处理含Cr2O![]() 废水,如下图所示;电解过程中溶液发生反应:Cr2O
废水,如下图所示;电解过程中溶液发生反应:Cr2O![]() +6Fe2++14H+===2Cr3++6Fe3++7H2O。
+6Fe2++14H+===2Cr3++6Fe3++7H2O。

(1)甲池工作时,NO2转变成绿色硝化剂Y,Y是N2O5,可循环使用。则石墨Ⅰ是电池的________极;石墨Ⅰ附近发生的电极反应式为__________________________________。
(2)工作时,甲池内的NO![]() 向___________极移动(填“石墨Ⅰ”或“石墨Ⅱ”);在相同条件下,消耗的O2和NO2的体积比为____________。
向___________极移动(填“石墨Ⅰ”或“石墨Ⅱ”);在相同条件下,消耗的O2和NO2的体积比为____________。
(3)乙池中Fe(Ⅰ)棒上发生的电极反应为_________________________________。
(4)若溶液中减少了0.01 mol Cr2O![]() ,则电路中至少转移了___________mol电子。
,则电路中至少转移了___________mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用。
(1)利用下图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
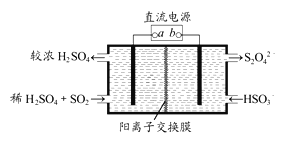
①阳极的电极反应式为__________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应中氧化剂与还原剂的物质的量之比为_________。
Ⅱ.乙炔(C2H2)在气焊、气割及有机合成中用途非常广泛,可由电石(CaC2)直接水化法或甲烷在1500℃左右气相裂解法生产。哈斯特研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。
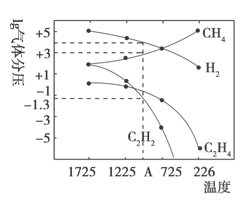
(2)T2℃时,向1L恒容密闭容器中充入0.3molCH4只发生反应2CH4(g)![]() C2H4(g)+2H2(g) ΔH,达到平衡时,测得c(C2H4)= c(CH4)。该反应的ΔH____0(填“>”或“<”),CH4的平衡转化率为_________。上述平衡状态某一时刻,若改变温度至T℃,CH4以0.01mol/(L·s)的平均速率增多,经ts后再次达到平衡,平衡时2c(C2H4) = c(CH4),则t=________s。
C2H4(g)+2H2(g) ΔH,达到平衡时,测得c(C2H4)= c(CH4)。该反应的ΔH____0(填“>”或“<”),CH4的平衡转化率为_________。上述平衡状态某一时刻,若改变温度至T℃,CH4以0.01mol/(L·s)的平均速率增多,经ts后再次达到平衡,平衡时2c(C2H4) = c(CH4),则t=________s。
(3)列式计算反应2CH4(g) =C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=_________(用平衡分压代替平衡浓度计算:lg![]() ≈ -1.3)。
≈ -1.3)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO(g)与H2O(g)反应的能量变化如图所示,有关两者反应的说法正确的是( )

A. 该反应为吸热反应
B. 该反应不需要加热就能进行
C. 1 molCO(g)和1mol H2O(g)具有的总能量大于1 molCO2(g)和1 molH2(g)具有的总能量
D. 1 molCO2(g)和1 molH2(g)反应生成1 molCO(g)和1mol H2O(g)要放出41 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料生产NiCl2,继而生产Ni2O3的工艺流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
(1)①为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有:适当升高温度,搅拌,______等。
②酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等。在沉镍前,需加Na2CO3控制溶液pH范围为______。
(2)“氧化”生成Ni2O3的离子方程式为______。
(3)工业上用镍为阳极,电解0.05 ~ 0.1 mol·L-1 NiCl2 溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如下图所示,则NH4Cl的浓度最好控制为______。

II、煤制天然气的工艺流程简图如下:

(4)已知反应I:C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+135 kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:______。
CO(g)+H2(g) ΔH=+135 kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:______。
(5)①甲烷化反应IV发生之前需要进行脱酸反应III。煤经反应I和II后的气体中含有两种酸性气体,分别是H2S和_____。
②工业上常用热碳酸钾溶液脱除H2S气体得到两种酸式盐,该反应的离子方程式是____。
(6)一定条件下,向体积为2L的恒容密闭容器中充入1.2 mol CH4(g)和4.8 mol CO2(g),发生反应:CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g) ΔH>0。实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如右图。计算该条件下,此反应的
2H2O(g)+4CO(g) ΔH>0。实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如右图。计算该条件下,此反应的![]() H=______。
H=______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com