
下列逻辑关系图示中正确的是
A | B | C | D |
|
|
|
|
科目:高中化学 来源:2014高考名师推荐化学电解规律及电化学计算(解析版) 题型:选择题
体积为1 L的某溶液中含有的离子如表所示:
离子 | Cu2+ | Al3+ |
| Cl- |
| 1 | 1 | a | 1 |
用Pt电极电解该溶液,当电路中有3 mol电子通过时(忽略电解时溶液体积的变化及电解产物可能存在的溶解现象),下列说法正确的是
A.电解后溶液的pH=0
B.a=3
C.阳极生成1.5 mol Cl2
D.阴极析出的金属是铜与铝
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质结构与性质推断(解析版) 题型:填空题
X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质。回答下列问题(相关回答均用元素符号表示):
(1)R的基态原子的核外电子排布式是 。
(2)Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低的原因是 。
(3)X与Z中电负性较大的是 。Z的某种含氧酸盐常用于实验室制取X形成的单质,此酸根离子的空间构型为 ,此离子中所含化学键的类型是 ,X—Z—X的键角 109°28′(填“>”、“<”或“=”,已知:孤电子对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对之间的斥力)。
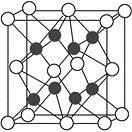 (4)X与Y形成的化合物Y2X的晶胞如图。其中X离子的配位数为 ,与一个X离子距离最近的所有的Y离子为顶点的几何体为 。该化合物与MgO相比,熔点较高的是 。
(4)X与Y形成的化合物Y2X的晶胞如图。其中X离子的配位数为 ,与一个X离子距离最近的所有的Y离子为顶点的几何体为 。该化合物与MgO相比,熔点较高的是 。
(5)已知该化合物的晶胞边长为a pm,则该化合物的密度为 g·cm-3(只要求列出算式,不必计算出数值,阿伏加德罗常数的数值为NA)。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质的量及相关计算(解析版) 题型:选择题
某同学用NaHCO3和KHCO3组成的固体混合物进行实验,测得实验数据(盐酸的物质的量浓度相等)如表所示:下列说法不正确的是
盐酸/mL | 50 | 50 | 50 |
固体混合物质量/g | 9.2 | 15.7 | 27.6 |
标准状况下CO2体积/L | 2.24 | 3.36 | 3.36 |
A.盐酸的物质的量浓度为3.0 mol/L
B.根据表中数据能计算出混合物中NaHCO3的质量分数
C.加入9.2 g固体混合物时盐酸过量
D.15.7 g固体混合物恰好与盐酸完全反应
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质的量及相关计算(解析版) 题型:选择题
在硫酸铝、硫酸钾和明矾的混合溶液中,如果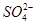 的浓度为0.2 mol·L-1,当加入等体积0.2 mol·L-1KOH溶液时,生成的沉淀恰好完全溶解,(忽略溶液中少量的H+和OH-)则反应后混合溶液中K+的浓度约是
的浓度为0.2 mol·L-1,当加入等体积0.2 mol·L-1KOH溶液时,生成的沉淀恰好完全溶解,(忽略溶液中少量的H+和OH-)则反应后混合溶液中K+的浓度约是
A.0.125 mol·L-1 B.0.225 mol·L-1
C.0.250 mol·L-1 D.0.450 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质的检验(解析版) 题型:选择题
下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结 论 |
A | 将少量Fe(NO3)2试样加水溶解,滴加稀H2SO4酸化,再滴加KSCN溶液 | 溶液变成红色 | Fe(NO3)2试样已变质 |
B | 将少量某无色气体通入澄清石灰水 | 出现白色沉淀 | 该气体一定是CO2 |
C | 分别测定常温下0.1 mol·L-1 Na2SiO3溶液和Na2CO3溶液的pH | pH:Na2SiO3> Na2CO3 | 非金属性:Si>C |
D | 向浓度均为0.1 mol·L-1 NaCl和NaI混合溶液中,滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质的分离和提纯(解析版) 题型:实验题
菠菜营养丰富,长期以来民间流传着“菠菜不能与豆腐同食”的说法。某学校化学兴趣小组的同学拟通过实验探究:菠菜是否含有草酸类物质?草酸又有哪些性质?通过上网查询,获得以下资料:草酸又名乙二酸,其酸性比乙酸稍强,草酸及其盐具有较强的还原性,草酸晶体(H2C2O4·2H2O)的熔点为100.1℃,在175℃时受热分解,草酸钙是难溶于水的白色固体。
他们设计的实验步骤如下:
1.将菠菜在少量开水中煮沸2~3 min,冷却后滤去菠菜,得滤液(含有少量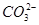 杂质)。向滤液中加入足量Ca(OH)2溶液,然后再加入足量CH3COOH溶液,观察现象。
杂质)。向滤液中加入足量Ca(OH)2溶液,然后再加入足量CH3COOH溶液,观察现象。
2.用草酸晶体(H2C2O4·2H2O)做以下实验:
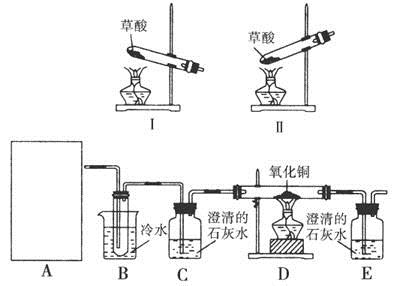
请回答以下问题:
(1)步骤1中加入CH3COOH溶液的作用: 。
(2)A处应选择 (填“Ⅰ”或“Ⅱ”),在做实验之前,应先 。
(3)实验2过程中观察到C、E装置中的溶液均变浑浊,且D装置中黑色粉末变为红色,写出A中草酸晶体(H2C2O4·2H2O)发生反应的化学方程式: ,装置B的作用是 。
(4)为使实验结论更加严密和安全,在以上所连接的装置C、D间还需依次添加装有 、 、 (液体试剂)的洗气瓶,此外指出上述装置中的不足之处还有 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学燃烧热与盖斯定律(解析版) 题型:选择题
下列说法正确的是
已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
A.H2(g)的燃烧热为571.6 kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.H2SO4(aq)+Ba(OH)2(aq)==BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学氮气、氧化物及硝酸(解析版) 题型:实验题
请分析回答某同学在探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铜反应的实验中发现的有关问题。
Ⅰ.探究上述四种酸的氧化性相对强弱及其与铜反应的还原产物的性质
(1)分别向盛有等量铜片的四支试管中加入等体积的浓硫酸、稀硫酸、浓硝酸、稀硝酸,实验结果记录如下表:
| 酸 | 实验结果 |
a | 浓硫酸 | 加热后发生反应,产生无色刺激性气体 |
b | 稀硫酸 | 加热也不发生反应 |
c | 浓硝酸 | 不加热即发生反应,产生红棕色气体 |
d | 稀硝酸 | 微热发生反应,产生无色气体 |
①由上表中实验结果,四种酸的氧化性由强到弱的顺序是 。
②由上表可知,铜与稀硫酸在加热条件下不反应,但若同时通入O2,铜片能逐渐溶解,溶液变为蓝色。写出该反应的化学方程式: 。
(2)先将铜与浓硫酸反应产生的气体X持续通入如图所示装置中,一段时间后再将铜与浓硝酸产生的气体Y也持续通入该装置中,则整个过程中可观察到的现象包括 (填字母)。

A.通入X气体后产生白色沉淀
B.通入X气体后溶液无明显现象
C.通入Y气体后产生沉淀
D.通入Y气体后沉淀溶解
E.通入Y气体后溶液中无明显现象
由此可得到的结论是 (填字母)。
A.硝酸的酸性比硫酸强
B.H2SO3的酸性比盐酸强
C.HNO3能氧化H2SO3(或SO2)
D.BaSO4既不溶于水也不溶于HNO3溶液
Ⅱ.如图是某同学探究铜与稀硝酸反应的还原产物的实验装置图,请回答下列问题:
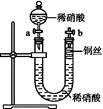
(1)写出铜与稀硝酸反应的离子方程式: 。
(2)已知装置气密性良好,请简述利用该装置证明铜与稀硝酸反应生成的气体产物是NO的操作过程: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com