
| A. | Ba(OH)2•8H2O与NH4Cl的反应 | B. | NaOH溶液与盐酸的反应 | ||
| C. | 甲烷与氧气的反应 | D. | 石灰石的分解反应 |
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的NH4Cl溶液中含NH4+的数目小于0.01NA | |
| B. | 该反应释放H2的分子数为$\frac{V}{22.4}$NA | |
| C. | 反应中每消耗2molH+转移的电子数为6NA | |
| D. | 120.5gNCl3中所含共价键数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HOCH2CH=CH2能发生取代反应,加成反应、氧化反应 | |
| B. | 月桂烯(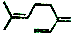 )所有碳原子一定在同一平面上 )所有碳原子一定在同一平面上 | |
| C. | 甲烷、乙烯、苯和乙醇都能使酸性KMnO4溶液褪色 | |
| D. | 油脂皂化反应得到高级脂肪酸与甘油 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
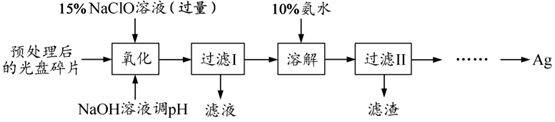
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
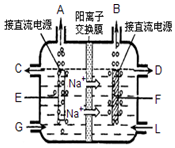 食盐是日常生活必需品,也是重要的化工原料.
食盐是日常生活必需品,也是重要的化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钾与硫酸的反应 | B. | 锌与盐酸反应放出氢气 | ||
| C. | CO2通过炽热的焦炭发生的反应 | D. | Ba(OH)2•8H2O与NH4Cl反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
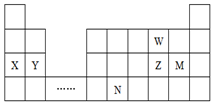
| A. | 原子半径:Y>Z>W,简单离子半径:M->Z2->W2- | |
| B. | 单质的还原性:X>Y,简单氢化物的沸点:Z>W | |
| C. | 溴与元素M同主族,最高价氧化物的水化物的酸性比M的强 | |
| D. | 元素N位于金属与非金属的分界线附近,可以推断N的单质可作 半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
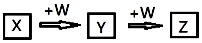 X、Y、Z、W均为中学化学中常见物质,一定条件下它们之间有如图转化关系(其它产物已略去):下列说法不正确的是( )
X、Y、Z、W均为中学化学中常见物质,一定条件下它们之间有如图转化关系(其它产物已略去):下列说法不正确的是( )| A. | 若W是强氧化性的单质,则X可能是金属铝 | |
| B. | 若W是氢氧化钠,则X水溶液为酸性 | |
| C. | 若W是单质铁,则Z溶液可能是FeCl2溶液 | |
| D. | 若W是氧气,则X、Z的相对分子质量可能相差48 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 1 | 2 | 3 | 4 |
| C(NO)/mol•L-1 | 9.50×10-3 | 4.50×10-3 | 2.50×10-5 | 1.50×10-3 | 1.5×10-3 |
| C(CO)/mol•L-1 | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
| A. | -定温度下,从开始到平衡,该反应的平衡常数逐渐增大 | |
| B. | 前2s内的平均反应速率v(N2)=1.75×10-3 mol•L-1•s-1 | |
| C. | 达到平衡时,CO的转化率为11.11% | |
| D. | 3s时NO和CO的浓度都不再变化,反应停止进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com