
下列说法正确的是 ( )。
A.根据反应Cu+H2SO4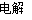 CuSO4+H2↑可推出Cu的还原性比H2的强
CuSO4+H2↑可推出Cu的还原性比H2的强
B.在反应CaH2+2H2O=Ca(OH)2+2H2↑中,水作氧化剂
C.反应3NO2+H2O=2HNO3+NO中氧化剂和还原剂的物质的量之比是3∶1
D.因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3=2NaIO3+Cl2不能发生
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源:2014年高中化学二轮创新训练上专题1物质组成分类性质及化学用语练习卷(解析版) 题型:选择题
下列用品的有效成分及用途对应错误的是( )。
ABCD
用品



有效成分NaClNa2CO3Al(OH)3Ca(ClO)2
用途做调味品做发酵粉做抗酸药做消毒剂
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题5化学反应与能量变化练习卷(解析版) 题型:填空题
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)=CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2
①上述反应符合“原子经济”原则的是________(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
温度 | 250 ℃ | 300 ℃ | 350 ℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断,ΔH1______0(填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为________,此时的温度为________(从上表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g)ΔH2=-566.0 kJ·mol-1
③H2O(g)=H2O(l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题4物质结构与元素周期律练习卷(解析版) 题型:选择题
X、Y、Z是位于不同周期的三种短周期元素,且原子序数逐渐增大,X、Z位于同一主族,三种元素可以形成原子个数比为1∶1∶1的化合物W。下列推测正确的是 ( )。
A.元素Z的氧化物一定属于碱性氧化物
B.原子半径:X<Y<Z
C.三种元素中,Y的金属性最强
D.Y、Z都能形成含氧酸,且前者的酸性比后者强
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题3常见的两种重要反应类型练习卷(解析版) 题型:选择题
在碘酸钠(NaIO3)的碱性溶液中通入氯气,可以得到高碘酸钠(Na2H3IO6)。下列有关该反应的说法错误的是 ( )。
A.在该反应中碘酸钠作还原剂
B.碱性条件下,氯气的氧化性强于高碘酸钠的氧化性
C.反应中生成1 mol Na2H3IO6转移2 mol电子
D.反应中氧化产物与还原产物的物质的量之比为2∶1
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题2常用化学计量-物质的量练习卷(解析版) 题型:选择题
下列叙述正确的是( )。
A.1 mol·L-1 NaCl溶液含有NA个Na+
B.10 mL质量分数为98%的H2SO4用水稀释至100 mL,H2SO4的质量分数应大于9.8%
C.配制240 mL 1 mol·L-1的NaOH溶液需称NaOH固体的质量为9.6 g
D.配制1 mol·L-1的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题2常用化学计量-物质的量练习卷(解析版) 题型:选择题
设NA为阿伏加德罗常数,下列说法不正确的是( )。
A.1.5 mol NO2与足量的H2O反应,转移的电子数为NA
B.常温常压下,0.5NA个CO2分子质量为22 g
C.28 g氮气所含的原子数目为NA
D.在标准状况下,0.5NA个氯气分子所占体积是11.2 L
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题13化学实验综合应用练习卷(解析版) 题型:实验题
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与硫酸反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定,以下实验过程不完整,请补充完整。
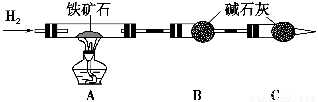
(1)按上图组装仪器,并______________________________________________;
(2)将8.0 g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
(3)从左端导气管口处不断地缓缓通入H2,____________________________,
点燃A处酒精灯;
(4)充分反应后,撤掉酒精灯,________________________________________;
(5)测得反应后装置B增重2.25 g,则铁矿石中氧的百分含量为________。
Ⅱ.铁矿石中含铁量的测定,流程如下。
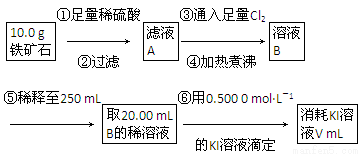
(1)步骤④中煮沸的作用是___________________________________________。
(2)步骤⑤中用到的玻璃仪器有烧杯、胶头滴管、250 mL容量瓶、________。
(3)下列有关步骤⑥的操作中说法正确的是________。
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.锥形瓶不需要用待测液润洗
c.滴定过程中可利用淀粉溶液作指示剂
d.滴定过程中,眼睛注视滴定管中液面变化
e.滴定结束后,30 s内溶液不恢复原来的颜色,再读数
f.滴定结束后,滴定管尖嘴部分有气泡,则测定结果偏大
(4)若滴定过程中消耗0.500 0 mol·L-1 KI溶液20.00 mL,则铁矿石中铁的百分含量为________。
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为________。
查看答案和解析>>
科目:高中化学 来源:2014年高一化学人教版必修二1-2-3元素周期表元素周期律应用练习卷(解析版) 题型:选择题
镁、锂在元素周期表中具有特殊“对角线”关系,它们的性质相似。例如,它们的单质在过量氧气中燃烧时均只生成正常的氧化物等,下列关于锂的叙述不正确的是( )
A.Li2SO4能溶于水
B.LiOH是易溶于水、受热不分解的强碱
C.Li遇浓硫酸不产生“钝化”现象
D.Li2CO3受热分解,生成Li2O和CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com