
| A. | ③⑥①②⑤④ | B. | ⑤①②⑥④③ | C. | ⑤④③②①⑥ | D. | ③①②④⑤⑥ |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 物质 | 沸点/℃ | 物质 | 沸点/℃ |
| 溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
| 苯甲醛 | 179 | 间溴苯甲醛 | 229 |
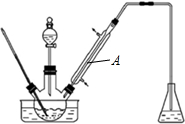
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向汽油中添加乙醇后,该混合燃料的热值不变,但可以达到减排的目的 | |
| B. | 侯氏制碱法的工艺流程应用了物质溶解度的差异 | |
| C. | 光导纤维、氧化铝陶瓷、PE、硅藻土都是无机非金属材料,橡胶、酚醛树脂都是人工合成高分子材料 | |
| D. | 泡沫灭火器是常见灭火器之一,其内筒为塑料桶,盛有碳酸氢钠溶液,外筒为金属材质,内外筒之间盛装硫酸铝溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-═2Fe2++I2+3H2O | |
| B. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| C. | 含有amolFeBr2的溶液中,通入0.4amolCl2:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 用两块铜片作电极电解盐酸:Cu+2H+$\frac{\underline{\;通电\;}}{\;}$H2↑+Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 | |
| 实验1 | 3.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 实验2 | 1.5mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
| 实验3 | 3.0mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
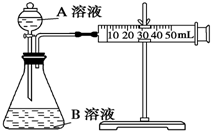 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.| 序号 | A | B |
| 1 | 2ml0.1mol/LH2C2O4溶液 | 4ml0.01mol/LKMnO4溶液 |
| 2 | 2ml0.2mol/LH2C2O4溶液 | 4ml0.01mol/LKMnO4溶液 |
| 3 | 2ml0.2mol/LH2C2O4溶液 | 4ml0.01mol/LKMnO4溶液和少量MnSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q=197KJ | B. | Q<197×2 KJ | C. | Q<197KJ | D. | Q>197KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com