
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 | |
| B. | 25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7 | |
| C. | 50℃时,NH4Cl和HCl的混合液中:c(NH4+)+c(H+)=c(OH-)+c(Cl-) | |
| D. | 0.1molAgCl和0.1molAgI混合后加入1L水中,所得溶液中c(Cl-)=c(I-) |
分析 A.加入醋酸钠,溶液中醋酸根离子浓度增大,抑制醋酸的电离;
B.25℃时,等体积等浓度的硝酸和氨水混合,两者恰好完全反应生成硝酸铵;
C.根据电荷守恒判断;
D.氯化银的溶解度大于碘化银.
解答 解:A.稀醋酸溶液中存在平衡:CH3COOH?CH3COO-+H+,加入醋酸钠,溶液中CH3COO-离子浓度增大,抑制醋酸的电离,故A错误;
B.25℃时,等体积等浓度的硝酸与氨水混合后为NH4NO3溶液,溶液中铵根离子水解,溶液呈酸性,故溶液pH<7,故B错误;
C.NH4Cl和HCl的混合液中存在电荷守恒,为:c(NH4+)+c(H+)=c(OH-)+c(Cl-),故C正确;
D.均存在溶解平衡,溶液中Ag+浓度相同,AgCl与AgI的溶度积不同,所得溶液中c(Cl-)≠c(I-),故D错误,
故选C.
点评 本题考查较为综合,涉及电离平衡的移动、酸碱混合后pH的计算和判断以及难溶电解质的溶解平衡,为高考常见题型,侧重考查学生的分析能力,难度不大,A为易错点,学生容易认为醋酸根与氢离子结合,平衡右移,促进电离.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:实验题
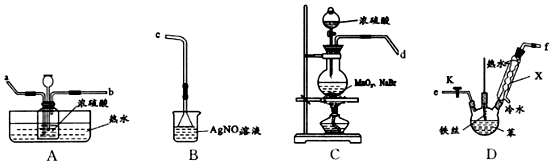
 ;仪器X的名称为球形冷凝管.
;仪器X的名称为球形冷凝管. ?
?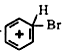
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:Z>W>Y | |
| B. | 气态氢化物的稳定性:Z<W | |
| C. | Z的氢化物能与其最高价氧化物对应的水化物反应 | |
| D. | 在X2和W2构成的燃料电池中,W2作负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L氯气与足量铁粉充分反应,转移的电子数为2NA | |
| B. | 28g乙烯和环丁烷的混合气体中含有的碳原子数为3NA | |
| C. | 0.5molNa2O2中含有NA个阴离子 | |
| D. | 1L0.1mol/LAl2(SO4)3溶液中含有的阳离子总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 亚硫酸钠在存放过程中会因为被氧化而变质,某研究性学习小组的同学对一种亚硫酸钠样品是否变质及变质程度进行了探究.
亚硫酸钠在存放过程中会因为被氧化而变质,某研究性学习小组的同学对一种亚硫酸钠样品是否变质及变质程度进行了探究.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HOCH2CHO能发生取代反应、加成反应、氧化反应 | |
| B. | 乙醇醛糖是一种有机物,能燃烧,可溶于水 | |
| C. | HOCH2CHO与乙酸、甲酸甲酯互为同分异构体 | |
| D. | 乙醇醛糖与葡萄糖具有相似的化学性质,且互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4(H+)、石蕊试液褪色 | |
| B. | 能使品红溶液褪色的不一定是SO2 | |
| C. | SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同 | |
| D. | 等物质的量的SO2和Cl2相遇在溶液中具有漂白能力 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
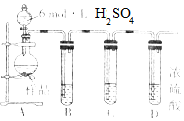
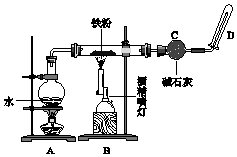 完成实验Fe与水蒸气反应,如图所示.
完成实验Fe与水蒸气反应,如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com