
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源:不详 题型:填空题
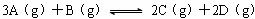 ,2分钟末反应达到平衡状态,生成了0.8mol D,请填写下面空白:
,2分钟末反应达到平衡状态,生成了0.8mol D,请填写下面空白:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2(g)+H2 (g) △H<0
CO2(g)+H2 (g) △H<0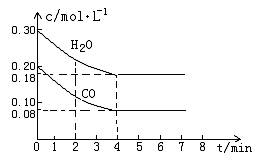
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
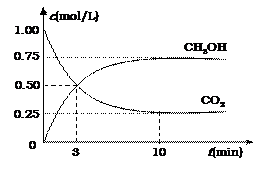
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) | A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离出去 | D.再充入1mol CO2和3mol H2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 x C(g)+2D(g),
x C(g)+2D(g),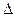 H <0,2min 末反应达到平衡状态(温度不变),生成了0.8 mol D,并测得C的浓度为0.4 mol/L,请填写下列空白:
H <0,2min 末反应达到平衡状态(温度不变),生成了0.8 mol D,并测得C的浓度为0.4 mol/L,请填写下列空白: 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.35% | B.30% | C.1/4 | D.1/5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
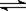 4C(g) + 6D(g) △H =-Q kJ/mol,在一定温度下达到化学平衡状态时,下列说法正确的是:( )
4C(g) + 6D(g) △H =-Q kJ/mol,在一定温度下达到化学平衡状态时,下列说法正确的是:( )查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
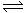 R(g)+2L此反应符合下面图像,
R(g)+2L此反应符合下面图像,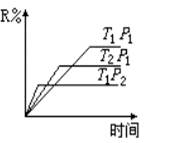
| A.T1> T2P1> P2 | B.T1> T2P1 < P2 |
| C. T1<T2P1> P2 | D. T1< T2P1 < P2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
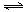 2(g);
2(g);| A.体系的压强不再改变 |
| B.体系的温度不再改变 |
| C.消耗1mol的同时,新生成3mol |
| D.反应消耗的、与产生的的速率υ():υ():υ() ==1: 3 : 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com