
| A. | 苯和甲苯 | B. | 苯乙烯与苯 | ||
| C. | 1-戊烯和邻-二甲苯 | D. | 苯和NaI溶液 |
分析 能使高锰酸钾褪色的物质有苯的同系物、烯烃、炔烃等,能使溴水褪色的为烯烃、炔烃等,据此进行解答.
解答 解:A.溴水不与苯和甲苯反应,无法鉴别,故A错误;
B.高锰酸钾能够氧化苯乙烯,乙烯能够与苯乙烯发生加成反应,而苯不与溴水和酸性高锰酸钾溶液反应,所以既能用酸性KMnO4 溶液,又能用溴水鉴别,故B正确;
C.1-戊烯和邻-二甲苯都能够与酸性高锰酸钾溶液反应,无法鉴别,故C错误;
D.碘单质颜色与高锰酸钾颜色相似,不能用酸性高锰酸钾鉴别苯和碘化钠,故D错误;
故选B.
点评 本题考查有机物的鉴别,为高频考点,把握有机物的性质及性质差异为解答的关键,侧重不饱和烃及苯的同系物性质的考查,注意现象相同不能区别物质,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 凡含有食品添加剂的食物对人体健康均有害,不宜食用 | |
| B. | 废弃的塑料,金属、纸制品及玻璃都是可回收再利用的资源 | |
| C. | 大气污染物SO2、CO和NO2主要来源于煤的燃烧和汽车排放的尾气 | |
| D. | 变质的油脂有难闻的特殊气味,是由于油脂发生了化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 | |
| 第2周期 | ⑥ | ⑦ | ||||||
| 第3周期 | ① | ③ | ⑤ | ⑩ | ⑧ | |||
| 第4周期 | ② | ④ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1:1:1 | B. | 4:3:2 | C. | 4:3:4 | D. | 1:5:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
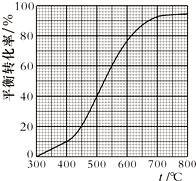 工业上以乙苯催化脱氢制取苯乙烯的反应如下:
工业上以乙苯催化脱氢制取苯乙烯的反应如下: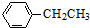 (g)$\stackrel{催化剂}{?}$
(g)$\stackrel{催化剂}{?}$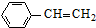 (g)+H2(g)
(g)+H2(g)| A. | 400℃时,向体系中通入水蒸气,v(正)、v(逆) 均减小,且乙苯转化率降低 | |
| B. | 500℃时,向体系中通入乙苯、苯乙烯、氢气各0.1x mol,平衡不移动 | |
| C. | 550℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=$\frac{9}{16}$×p总 | |
| D. | 550℃时平衡体系中苯乙烯的体积分数是450℃时的3倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
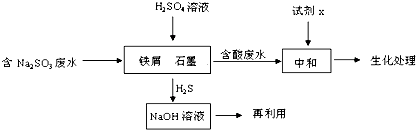
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com