
 (1)在容积为2L的密闭容器中,保持体系内温度800℃不变,将一定量的NO和O2混合发生反应:2NO+O2?2NO2,其中NO的物质的量(n)随时间(t)的变化关系如图所示,请回答下列问题.
(1)在容积为2L的密闭容器中,保持体系内温度800℃不变,将一定量的NO和O2混合发生反应:2NO+O2?2NO2,其中NO的物质的量(n)随时间(t)的变化关系如图所示,请回答下列问题.| 反应时间/min | n(SiF4)/mol | n(H2O)/mol |
| 0 | 1.20 | 2.40[ |
| t1 | 0.80 | a |
| t2 | b | 1.60 |
分析 (1)①曲线Ⅱ表示的物质的量减小是反应物,曲线Ⅰ表示的物质的量增大是生成物;
②根据氮元素守恒,当n(NO)=n(NO2)时,n(NO)=n(NO2)=0.1mol,依此判断平衡移动和反应热;
③缩小容器体积,压强增大,据此判断平衡移动;
(2)①根据化学平衡状态的特征分析,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、质量、体积分数以及百分含量不变,以及由此衍生的一些量也不发生变化,注意选择的物理量应随反应进行发生变化,该物理量由变化到不变,说明到达平衡;
②依据化学平衡三段式列式计算,结合热化学方程式分析判断.
解答 解:(1)①曲线Ⅱ表示的物质的量减小是反应物,曲线Ⅰ表示的物质的量增大是生成物,所以曲线Ⅰ表示NO2的变化,故答案为:Ⅰ;
②根据氮元素守恒,当n(NO)=n(NO2)时,n(NO)=n(NO2)=0.1mol,与图中的平衡比较,NO物质的量增加了,所以升高温度平衡向逆反应方向移动,故正反应为放热反应,
故答案为:放;
③缩小容器体积,压强增大,平衡向正反应方向移动,所以NO的物质的量减少,即达新平衡时n(NO)<0.07mol;平衡向正反应方向移动,则NO转化率增大,
故答案为:<;增大;
(2)①a、υ消耗(SiF4)=υ生成(HF),都表示正反应速率,且比例关系不等于化学计量数之比,不能说明到达平衡状态,故错误;
b、正反应是气体物质的量增大的反应,随反应进行容器内压强增大,容器内气体压强不再变化说明到达平衡状态,故正确;
c、反应有固体生成,随反应进行气体的总质量减小,容器内气体的总质量不再变化,说明到达平衡状态,故正确;
d、平衡时,各组分的含量不变,HF体积分数不再变化,说明到达平衡状态,故正确;
故答案为:bcd;
②由表中数据可知,t1时△n(SiF4)=1.2mol-0.8mol=0.4mol,根据方程式可知△n(H2O)=2△n(SiF4)=0.8mol,故t1时刻,水的物质的量=2.4mol-0.8mol=1.6mol,说明在一定条件下,t1~t2时各组分的浓度(或物质的量)均已不再发生改变,所以t1时反应已经达到化学平衡状态.
故答案为:t1时反应已经达到化学平衡状态.
点评 本题考查了反应速率和化学平衡的有关知识,注意理解化学平衡状态的判断,侧重于基本原理的应用,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
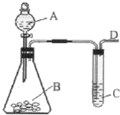 某同学用如图所示装置探究SO2的性质及其有关实验.
某同学用如图所示装置探究SO2的性质及其有关实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.08 mol/(L•s) | B. | 0.8 mol/(L•s) | C. | 1.6mol/(L•s) | D. | 2.4 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S不变,K变大,O2转化率增大 | B. | S不变,K变大,SO2转化率减小 | ||
| C. | S变小,K不变,O2转化率减小 | D. | S增大,K不变,SO2转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓的强酸和稀的强碱溶液反应 | B. | 浓的弱酸和稀的强碱溶液反应 | ||
| C. | 等浓度的强酸和弱碱溶液反应 | D. | 生成一种强酸弱碱盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 咖啡酸(如图)存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,特别是对内脏的止血效果较好.下列关于咖啡酸的说法正确的是( )
咖啡酸(如图)存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,特别是对内脏的止血效果较好.下列关于咖啡酸的说法正确的是( )| A. | 咖啡酸的分子式为C9H5O4 | |
| B. | 咖啡酸的某种同分异构体,其苯环上可能连有4个羟基 | |
| C. | 1 mol咖啡酸最多可以和2 mol NaOH反应 | |
| D. | 可以用高锰酸钾或溴水检验咖啡酸分子中所含的碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | A2的生成速率与AB的分解速率相等 | |
| B. | 单位时间内生成 2nmolAB,同时生成 nmolA2 | |
| C. | 单位时间内1molA-A键断裂,同时断裂2molA-B | |
| D. | A2、B2、AB的浓度不再变化,且A2、B2、AB的分子数之比为1:1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com