
 并五苯的荧光信号,该项工作被称为里程碑式的贡献.并五苯一氯取代物数目为( )
并五苯的荧光信号,该项工作被称为里程碑式的贡献.并五苯一氯取代物数目为( )| A. | 4 | B. | 6 | C. | 7 | D. | 11 |
科目:高中化学 来源: 题型:解答题


 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

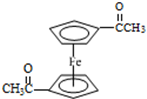 ),可以使用的仪器分析方法是质谱法或核磁共振氢谱.
),可以使用的仪器分析方法是质谱法或核磁共振氢谱.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 少量二氧化硫气体通入到漂白粉溶液中;Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO | |
| B. | 向Fe(OH)3中加入氢碘酸:Fe(OH)3+3H+=Fe3++3H2O | |
| C. | 少量的钠投入足量的水中:2Na+2H2O=2Na++2OH-+H2↑ | |
| D. | 向硫酸氢钠溶液中滴入氢氧化钡溶液至pH=7 Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 编号 | A | B | C | D |
| 实验 方案 | 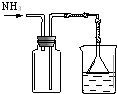 |  | 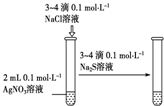 |  置于光亮处 |
| 实验 目的 | 收集氨气及并进行 尾气吸收 | 制取乙炔并验证炔烃 的性质 | 验证AgCl沉淀可转化为 溶解度更小的Ag2S沉淀 | 验证甲烷与氯气发生化学反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 分子式为C4H6O3,每摩尔该物质充分燃烧需消耗4mol O2 | |
| B. | 能发生取代、加成、氧化、加聚、中和等反应 | |
| C. | 分别与足量Na、NaOH、Na2CO3反应,生成物均为NaOOC-CH═CH-CH2OH | |
| D. | 该分子含有两种官能团 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com