
| A. | 铝不活泼 | B. | 铝表面有致密氧化膜 | ||
| C. | 铝化学性质稳定 |
科目:高中化学 来源: 题型:选择题
| A. | 硫的还原性 | B. | 硫的漂白性 | ||
| C. | 二氧化硫的还原性 | D. | 二氧化硫的漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
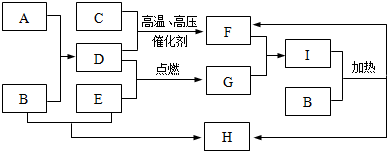
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
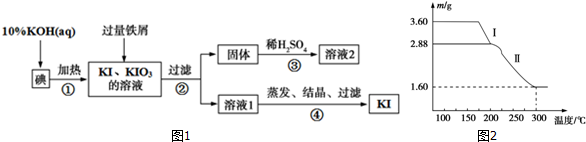
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12.8g | B. | 9.6g | C. | 6.4g | D. | 3.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
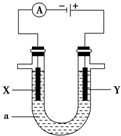 电解原理在化学工业中有着广泛的应用.现将设计的原电池通过导线与下图中电解池相连,其中,a为电解质溶液,X和Y是两块电极板,则:
电解原理在化学工业中有着广泛的应用.现将设计的原电池通过导线与下图中电解池相连,其中,a为电解质溶液,X和Y是两块电极板,则:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com