
【题目】一定条件下的密闭容器中:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H=-905.9kJ·mol-1。下列叙述正确的是
4NO(g)+6H2O(g) △H=-905.9kJ·mol-1。下列叙述正确的是
A.4molNH3和5molO2反应,达到平衡时放出热量为905.9kJ
B.平衡时,5v正(O2)=4v逆(NO)
C.平衡后降低压强,混合气体平均摩尔质量增大
D.平衡后升高温度,混合气体中NO含量降低
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列叙述中错误的是( )
①标准状况下,2.24 L水中含有0.1 NA个水分子
②常温常压下,32g SO2 含有的分子数为0.5NA
③2 mol NaOH的摩尔质量为80g/mol
④H2的气体摩尔体积约为22.4L/mol
⑤2mol/L的CaCl2溶液中Cl-的数目为4NA
⑥常温常压下,1mol氦气含有的原子数为NA
A.2个B.3个C.4个D.5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为_______________;
(2)Y元素原子的价层电子的轨道表示式为_____________;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是___________;
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物沸点高低______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究某橙色含结晶水的盐X的组成和性质,设计并完成如图实验。请回答:

(1)X的化学式是___。
(2)乙化学性质与其组成元素的单质相似,下列物质中能与乙发生反应的是__(填写相应的字母)。
A.Mg B.CaCl2 C.NaOH D.K2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭.导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca =CaCl2+Li2SO4+Pb。

下列有关说法正确的是
A .正极反应式:Ca+2Cl- - 2e- =CaCl2
B.放电过程中,Li+向负极移动
C.常温时,在正负极间接上电流表或检流计,指针不偏转
D.每转移0.1mol电子,理论上生成20.7g Pb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在①![]() Li ②石墨 ③C60 ④
Li ②石墨 ③C60 ④![]() Mg ⑤ CH3CH2OH ⑥
Mg ⑤ CH3CH2OH ⑥![]() C ⑦
C ⑦![]() Li ⑧ CH3OCH3 中:____互为同位素; ____互为同分异构体;___互为同素异形体(填序号)
Li ⑧ CH3OCH3 中:____互为同位素; ____互为同分异构体;___互为同素异形体(填序号)
(2)现有①CaCl2 ②金刚石 ③NH4Cl ④Na2SO4 ⑤冰 等五种物质,按下列要求回答:
①熔化时不需要破坏化学键的是___________,熔点最高的是_______。(填序号)
②只含有离子键的物质是______,晶体以分子间作用力结合的是______。(填序号)
(3)写出下列物质的电子式
①H2O______
②NaOH______
③NH3______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mLpH=3的醋酸溶液中加入水稀释后,下列说法正确的是
A.溶液中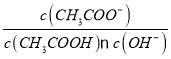 不变
不变
B.溶液中导电粒子的数目减少
C.醋酸的电离程度增大,c(H+)亦增大
D.完全致中和醋酸需加入10mLpH=11的NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按下列要求填空:
(1)甲基的电子式__________;
(2)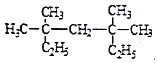 系统命名法为_________________;
系统命名法为_________________;
(3)键线式![]() 表示的有机物的结构简式是____________;
表示的有机物的结构简式是____________;
(4)烷烃A在同温同压下蒸气的密度是H2的36倍,烷烃A的结构简式为________________.
(5)相对分子质量为70的烯烃的分子式为_________,若该烯烃与足量H2加成后能生成含3个甲基的烷烃,则该烯烃可能的结构简式为_________。
(6)写出下列反应的化学方程式:
①实验室制取乙炔_____________________________________________________。
②2 -氯丙烷的消去反应_____________________________________________________。
③用甲苯制TNT的反应_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子.在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2XCl+2CO+2H2O═X2Cl2·2CO·2H2O
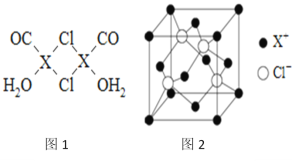
(1)X基态原子的电子排布式为__________________.
(2)C、H、O三种原子的电负性由大到小的顺序为__________.
(3)X2Cl2·2CO·2H2O是一种配合物,其结构如图1所示:
①与CO为互为等电子体的分子是_________.
②该配合物中氯原子的杂化方式为__________.
③在X2Cl22CO2H2O中,每个X原子能与其他原子形成3个配位键,在图中用“→”标出相应的配位键_____________.
(4)阿伏加德罗常数的测定有多种方法,X射线衍射法就是其中的一种。通过对XCl晶体的X射线衍射图象的分析,可以得出XCl的晶胞如图2所示,则距离每个X+最近的Cl﹣的个数为____________,若X原子的半径为a pm,晶体的密度为ρg/cm3,试通过计算阿伏加德罗常数NA=___________________(列计算式表达)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com