
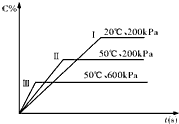
 在密闭容器中进行以下可逆反应:A(g)+B(g)?C(g)+2D(?),在不同的条件下C的百分含量的变化情况如如图,则该反应描述正确的是( )
在密闭容器中进行以下可逆反应:A(g)+B(g)?C(g)+2D(?),在不同的条件下C的百分含量的变化情况如如图,则该反应描述正确的是( )| A、正反应放热,D是固体 |
| B、正反应放热,D是气体 |
| C、正反应吸热,D是气体 |
| D、正反应放热,D是固体或气体 |


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
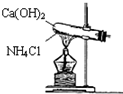 实验室通常用如图所示的装置来制取氨气,(收集装置略).回答下列问题:
实验室通常用如图所示的装置来制取氨气,(收集装置略).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硒化氢是无色、有毒、比硫化氢稳定的气体 |
| B、砹单质是一种有色固体,砹化氢很不稳定,砹化银是难溶于水的白色沉淀 |
| C、硫酸锶难溶于水,但易溶于盐酸 |
| D、铍(Be)是一种轻金属,它的氧化物的水化物可能具有两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
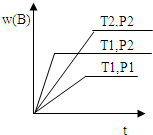 已知某反应aA(g)+bB(g)?cC(g)△H=Q 在密闭容器中进行,在不同温度(T1和T2 )及压强(P1 和P2 )下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示,下列判断正确的是( )
已知某反应aA(g)+bB(g)?cC(g)△H=Q 在密闭容器中进行,在不同温度(T1和T2 )及压强(P1 和P2 )下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示,下列判断正确的是( )| A、T1<T2,P1<P2,a+b>c,Q>0 |
| B、T1>T2,P1<P2,a+b<c,Q<0 |
| C、T1<T2,P1>P2,a+b<c,Q>0 |
| D、T1<T2,P1>P2,a+b>c,Q<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
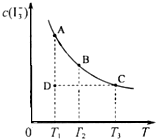 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq) 某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq) 某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )| A、反应I2(aq)+I-(aq)?I3-(aq)的△H>0 |
| B、若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1<K2 |
| C、若反应进行到状态D时,平衡向逆反应方向移动 |
| D、状态B与状态C相比,状态C的c(I2)大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
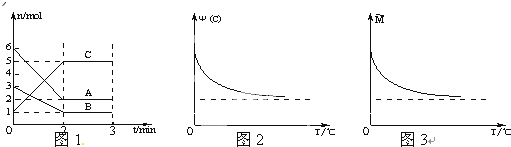
| A、前2min中C的平均反应速率为1mol/L?min |
| B、该反应的化学方程式为:2A+B?2C |
| C、正反应是放热反应 |
| D、A、B一定均为气态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
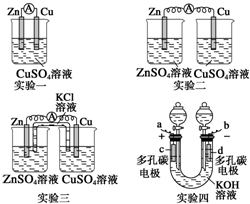 某校化学兴趣小组为了探究原电池工作原理,进行下列实验,请分析实验结果后回答相应问题.
某校化学兴趣小组为了探究原电池工作原理,进行下列实验,请分析实验结果后回答相应问题.查看答案和解析>>
科目:高中化学 来源: 题型:
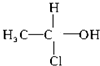 .下列化合物中存在对映异构体的是( )
.下列化合物中存在对映异构体的是( )| A、C2H5CH=CHCH(CH3)-CH=CHC2H5 |
B、 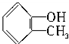 |
| C、甲酸 |
| D、C6H5CH(CH3)OCH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com