
| A、c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-) |
| B、c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| C、c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-) |
| D、c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) |
| 2×10-5mol |
| 0.013L |
| Ksp(AgCl) |
| c(Cl-) |
| (1.25×10-5)2 |
| 1.53×10-3 |
| Ksp(AgI) |
| c(Ag+) |
| (1.22×10-8)2 |
| 1.02×10-7 |


科目:高中化学 来源: 题型:

| A、H2O和D2O是同位素 |
| B、氢氧两种元素只能组成水 |
| C、水分子之间不只存在范德华力 |
| D、图中球棍模型也可表示CO2的结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| W | X | ||
| Y | Z |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp[CaSO4] |
| B、Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
| C、已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,该温度下反应Fe(OH)3+3H+?Fe3++3H2O的平衡常数K=4.0×104 |
| D、已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,在MgCl2溶液中加入氨水,测得混合液的pH=11,则溶液中的c(Mg2+)为1.8×10-3mol.L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 光 |
| Br2 |
| NaOH,醇 |
| △ |
| Br水 |
| NaOH,H2O |
| O2,催化剂 |
| △ |
| O2,催化剂 |
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 3-n |
| 2 |
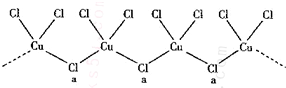
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、整个反应过程中:c(H+)+c(Na+)+c(NH4+)=c(OH-)+2c(SO42-) |
| B、当滴入30mL NaOH溶液时(pH>7):c(NH4+)>c(NH3?H2O)>c(OH-)>c(H+) |
| C、当滴入20mL NaOH溶液时:2c(SO42-)=c(NH3?H2O)+c(NH4+) |
| D、当溶液呈中性时:c(NH4+)>c(SO42-)>c(Na+)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用水湿润pH试纸测量某溶液的pH值 |
| B、盛放NaOH溶液时.使用带玻璃塞的磨口瓶 |
| C、用50 mL酸式滴定管可准确量取25.00 mLKMnO4溶液 |
| D、用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com