
| A. | 此溶液中Na2SO3已部分氧化? | |
| B. | 加入Ba(NO3)2溶液生成的沉淀一定含BaSO4? | |
| C. | 加HCl后的不溶沉淀一定为BaSO4? | |
| D. | 此样品未被氧化? |
分析 Na2SO3溶液被氧化生成硫酸钠,加硝酸钡反应均生成白色沉淀,且亚硫酸钡可被硝酸氧化为硫酸钡,以此来解答.
解答 解:A.取少量溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加入足量稀盐酸,充分振荡后,仍有白色沉淀,硝酸根离子在酸溶液中具有氧化性,原溶液中可以是硫酸根离子或亚硫酸根离子,不能说明此溶液中Na2SO3已部分氧化,故A错误;
B.硝酸根离子在酸溶液中具有氧化性亚硫酸根离子被氧化为硫酸根离子,加入Ba(NO3)2溶液后,生成的沉淀中不一定含有BaSO4,故B错误;
C.取少量溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加入足量盐酸,充分振荡后,仍有白色沉淀,硝酸根离子在酸溶液中具有氧化性,可氧化亚硫酸根离子生成硫酸根离子,加硝酸后生成沉淀一定是BaSO4,故C正确;
D.硝酸根离子在酸溶液中具有氧化性,原溶液中可以是硫酸根离子或亚硫酸根离子,此实验不能确定Na2SO3是否部分被氧化,故D错误;
故选C.
点评 本题考查物质的鉴别和检验,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意把握物质的性质、发生的反应及离子检验为解答该题的关键,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
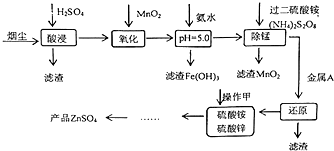 高炉炼铁的烟尘中主要含有锌、铁、铜等金属元素.从烟尘中提取硫酸锌,可以变废为宝,减少其对环境的危害.如图是用高炉烟尘制取硫酸锌的工业流程.
高炉炼铁的烟尘中主要含有锌、铁、铜等金属元素.从烟尘中提取硫酸锌,可以变废为宝,减少其对环境的危害.如图是用高炉烟尘制取硫酸锌的工业流程.| pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
| 开始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
| 沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
| 沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
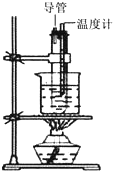 用苯和浓硝酸、浓硫酸按照如图装置制取硝基苯,回答下列问题:
用苯和浓硝酸、浓硫酸按照如图装置制取硝基苯,回答下列问题: ;反应类型:取代反应.
;反应类型:取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌锰干电池是二次电池 | |
| B. | 铜片、锌片、导线和甜橙组成的水果电池,负极是铜片 | |
| C. | 铅蓄电池的放电过程,从能量转换形式看是化学能转化为电能 | |
| D. | 原电池工作时溶液中的阳离子移向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A<B<C<D | |
| B. | 非金属性:A>C | |
| C. | B和D最高价氧化物对应水化物相互不反应 | |
| D. | 单质B常温下能溶于浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
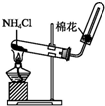
| A. | 氨和铵盐都易溶于水,都能生成NH4+ | |
| B. | 铵态氮肥与碱性物质如草木灰混合施用肥效更高 | |
| C. | 实验室制备氨气的试剂和装置可为如图装置 | |
| D. | 工业上用氨气液化需吸收热量的过程做制冷剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com