
| A. | 用金属钠可鉴别乙醇和乙醚 | |
| B. | 用新制的银氨溶液可鉴别甲酸乙酯和丙醛 | |
| C. | 用水可鉴别苯和溴苯 | |
| D. | 用酸性高锰酸钾溶液可鉴别己烷和3-己烯 |
分析 A.乙醇与Na反应生成氢气,乙醚不能;
B.甲酸乙酯和丙醛均含-CHO;
C.苯的密度比水小,溴苯密度比水大,均不溶于水;
D.3-己烯含碳碳双键,能被高锰酸钾氧化,而己烷不能.
解答 解:A.乙醇与Na反应生成氢气,乙醚不能,则金属钠可鉴别,故A正确;
B.甲酸乙酯和丙醛均含-CHO,则用新制的银氨溶液不能鉴别甲酸乙酯和丙醛,故B错误;
C.苯的密度比水小,溴苯密度比水大,均不溶于水,则与水混合分层现象不同,可鉴别,故C正确;
D.3-己烯含碳碳双键,能被高锰酸钾氧化,而己烷不能,则用酸性高锰酸钾溶液可鉴别己烷和3-己烯,故D正确;
故选B.
点评 本题考查物质的鉴别和检验,为高频考点,把握有机物的结构与性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意有机物性质的应用,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 4.8g滤渣是由3.2g铜和1.6g铁组成 | B. | ω=14.7 | ||
| C. | 反应过程中产生的氢气是2.24L | D. | 滤液是20.88%的硫酸亚铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 90 g丙醇中存在的共价键总数为15 NA | |
| B. | 1 mol的羟基与1 mol的氢氧根离子所含电子数均为9 NA | |
| C. | 过氧化钠与水反应时,生成0.1 mol O2转移的电子数为0.2 NA | |
| D. | 2 L 0.5 mol/L亚硫酸溶液中含有的H+离子数为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 危化品储存运输过程中发生金属钠、镁着火时,应立即用泡沫灭火器灭火 | |
| B. | 配制银氨溶液的操作:在2 mL 2%的硝酸银溶液中逐滴加入2%的氨水、振荡试管,直至产生的沉淀恰好完全溶解 | |
| C. | 配制230mL 0.1mol•L-1的FeCl3溶液:称取一定质量的FeCl3固体在烧杯中溶于适量盐酸中,放置至室温后,再转移入250mL容量瓶中进行配制 | |
| D. | 取少量硫酸亚铁铵晶体用蒸馏水溶解,加入适量10%的NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝色的气体,说明晶体中含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油中含有1~50个碳原子的烷烃及环烷烃 | |
| B. | 石油分馏是物理变化,裂化、裂解和催化重整属于化学变化 | |
| C. | 石油裂化的目的主要是提高汽油的产量 | |
| D. | 裂化主要是将链烃变为芳香烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
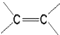 )中的π-键不能自由旋转,因此
)中的π-键不能自由旋转,因此 和
和 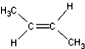 是两种不同的化合物,互为顺反异构体.则分子式为C3H2Cl4的化合物的链状异构体有( )
是两种不同的化合物,互为顺反异构体.则分子式为C3H2Cl4的化合物的链状异构体有( )| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
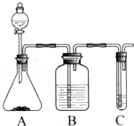 Ⅰ.实验室常用如图中的装置制备乙炔并检验乙炔的性质:
Ⅰ.实验室常用如图中的装置制备乙炔并检验乙炔的性质: ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 0.1032mol/L HCl溶液体积/mL | 待测NaOH溶液体积/mL |
| 1 | 27.83 | 25.00 |
| 2 | 26.53 | 25.00 |
| 3 | 27.85 | 25.00 |
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com