
| A. | MgCl2、Na2SO4、K2SO4 | B. | KCl、Na2SO4、NaCl | ||
| C. | NaCl、Na2SO4、K2SO4 | D. | KCl、Na2SO4、K2SO4 |
分析 根据c(K+)=c(Cl-)=$\frac{1}{3}$ c(Na+)=$\frac{2}{3}$c(SO42-),结合各选项中溶质的组成进行判断是否满足各离子浓度关系即可.
解答 解:A.若溶质为MgCl2、Na2SO4、K2SO4,根据物料守恒知,c(Na+)<2c(SO42-),与$\frac{1}{3}$c(Na+)=$\frac{2}{3}$c(SO42-)不符,故A错误;
B.若溶质为KCl、Na2SO4、NaCl,则c(Na+)>2c(SO42-),与$\frac{1}{3}$c(Na+)=$\frac{2}{3}$c(SO42-)不符,故B错误;
C.若溶质为NaCl、Na2SO4、K2SO4,溶液中的离子可能存在c(K+)=c(Cl-)=0.5c(Na+)=c(SO42-),故C正确;
D.若溶质为KCl、Na2SO4、K2SO4,则c(K+)>c(Cl-),与c(K+)=c(Cl-)不符,故D错误;
故选C.
点评 本题考查电解质在水中的电离及离子浓度的关系,明确电解质在水中电离产生的离子及离子的物质的量的关系即可解答,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 硫酸工业尾气中的SO2用过量的氨水吸收:2NH3•H2O+SO2═2NH4++SO32-+H2O | |
| B. | FeO和稀HNO3的反应:FeO+2H+═Fe2++H2O | |
| C. | 向NH4Cl溶液中滴入烧碱溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3•H2O | |
| D. | 向NaClO溶液中通入少量SO2:2ClO-+SO2+H2O═2HClO+SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
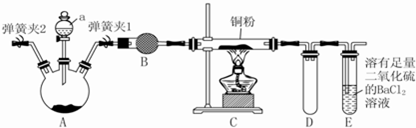
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时OH-向负极移动 | |
| B. | Ag2O2在反应中既是氧化剂又是还原剂 | |
| C. | 每生成1mol Ag外电路转移2 mol电子 | |
| D. | 负极反应为:Zn+4OH--2e-═Zn(OH)42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4ac/bNA | B. | 22.4ab/cNA | C. | 22.4bc/aNA | D. | 22.4b/acNA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com