
 CO2(g)下列说法中错误的是 ( )
CO2(g)下列说法中错误的是 ( )| A.将木炭粉碎成粉末状可以加快化学反应速率 |
| B.升高温度可以加快化学反应速率 |
| C.把容器的体积缩小到原来的一半,各物质的物质的量不变, 化学反应速率不变 |
| D.增加木炭的量可以加快化学反应速率 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题
 HCOOH + CH3OH – Q(Q>0)
HCOOH + CH3OH – Q(Q>0)| 组分 | 物质的量/mol |
| HCOOCH3 | 1.00 |
| H2O | 1.99 |
| HCOOH | 0.01 |
| CH3OH | 0.52 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 pC(g)+qD(S)△H<0如图某反应过程中各物质物质的量n(mol)随时间t的变化曲线图。
pC(g)+qD(S)△H<0如图某反应过程中各物质物质的量n(mol)随时间t的变化曲线图。
 2C(g) △H<0。若该反应的正反应速率与时间的关系如图所示。在其它条件不变的情况下,请填空:
2C(g) △H<0。若该反应的正反应速率与时间的关系如图所示。在其它条件不变的情况下,请填空:
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
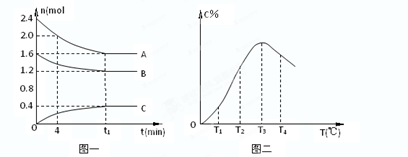
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化 |
B.图②表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(g)的影响,且乙的压强大 3C(g)+D(g)的影响,且乙的压强大 |
| C.图③表示向Al2(SO4)3和MgSO4的混合液中滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液体积的关系 |
| D.图4表示在2L的密闭容器中发生合成氨反应时N2的物质的量随时间的变化曲线,0~10min内该反应的平均速率v(H2)=0.045mol·L-1·min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为d |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g)若经2s 后测得C的浓度为0.6mol?L-1现有下列几种说法其中不正确的是 ( )
2C(g)若经2s 后测得C的浓度为0.6mol?L-1现有下列几种说法其中不正确的是 ( )| A.用物质A表示的反应的平均速率为0.3 mol?L-1?s-1 | B.2s时的压强是起始时的1.1倍 |
| C.2s时物质A的转化率为30% | D.2s时物质B的浓度为0.7 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 nZ(g)+2W(g) , 5 min末反应达到平衡状态,此时已生成0.2molW,若测知以Z浓度变化来表示的反应平均速率为0.01mol/L·min
nZ(g)+2W(g) , 5 min末反应达到平衡状态,此时已生成0.2molW,若测知以Z浓度变化来表示的反应平均速率为0.01mol/L·min查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 与H2合成二甲醚的化学方程式为 .
与H2合成二甲醚的化学方程式为 . CO(g)+3H2(g)……(I)、CO(g)+H2O(g)
CO(g)+3H2(g)……(I)、CO(g)+H2O(g) CO2(g)+H2(g)……(Ⅱ)催化反应室C中发生的反应为:
CO2(g)+H2(g)……(Ⅱ)催化反应室C中发生的反应为: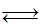 CH3OH(g)……(Ⅲ)、CO2(g)+3H2(g)
CH3OH(g)……(Ⅲ)、CO2(g)+3H2(g)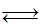 CH3OH(g)+H2O(g)……(Ⅳ)
CH3OH(g)+H2O(g)……(Ⅳ) ×100%,试求反应(Ⅳ)的原子利用率为 。
×100%,试求反应(Ⅳ)的原子利用率为 。
 收。
收。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com