
右图为某钙片的商品标签,请根据标签的有关信息完成下列各题:
(1)主要成分碳酸钙(CaCO3)由________种元素组成。
(2)碳酸钙中钙、碳、氧元素的质量比为______________。
(3)某儿童按标签用量服药,每天补充钙元素质量是________g。

科目:高中化学 来源: 题型:
点燃两支短蜡烛,分别放在白铁皮架的两个阶梯上,把铁皮架放在烧杯里,沿烧杯壁倾倒二氧化碳.在实验过程中观察到的现象是__________________________;说明二氧化碳具有_______________________的性质。
查看答案和解析>>
科目:高中化学 来源: 题型:
对下面符号或示意图的理解,正确的是( )
A.Fe2+、Fe3+都属于铁元素,是同一种离子
B.NO2、N2O4中氮元素的化合价都是+4价,是同一化合物
C.NH4NO3中氮元素有两种不同的化合价,分别是-3、+5
D.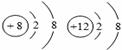 两种粒子的电子排布情况相同,属于同一元素
两种粒子的电子排布情况相同,属于同一元素
查看答案和解析>>
科目:高中化学 来源: 题型:
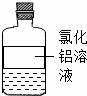
根据图示信息,用化学用语填空:
(1)写出氯化铝中金属元素的元素符号 ;
(2)写出溶液中大量存在的阴离子的符号 ;
(3)标出溶剂中氧元素的化合价 ;
(4)写出氯化铝的化学式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
近年来,因建设“PX”项目而引发的争议时有发生,PX是一种重要的化工原料,从化纤织物到食品包装,从医疗设备到家用电器,都要用到它的合成产物.PX的化学名称为对二甲苯,它是一种低毒化合物,毒性略高于酒精.
请回答下列有关问题:
(1)对二甲苯的分子结构模型如图所示,其中“ ”代表碳原子.“
”代表碳原子.“ ”代表氢原子.试根据分子模型写出对二甲苯的化学式 。
”代表氢原子.试根据分子模型写出对二甲苯的化学式 。
(2)对二甲苯中各元素的质量比 .
(3)PX项目之所以会引发各种争议,源于人们对它认识的局限性.结合题干信息,在下列各种观点中,选出你认同的一种观点 (选填字母).
A.PX是一种重要的化工原料,应该大力发展PX项目
B.在环保评估可行且监管到位的情况下,可以发展PX项目
C.化工项目一定会产生污染,应该禁止PX项目.

查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W、R属于短周期主族元素。X的原子半径短周期主族元素中最大,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m—n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1。 下列叙述错误的是( )
A.X与Y形成的两种化合物中阴、阳离子的个数比均为1∶2
B.Y的氢化物比R的氢化物稳定,熔沸点高
C.Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z
D.RY2、WY2通入BaCl2溶液中均有白色沉淀生成。
查看答案和解析>>
科目:高中化学 来源: 题型:
研究化肥的合成、废水的处理等有现实的重要意义。
Ⅰ.尿素是一种非常重要的高氮化肥,工业上合成尿素的反应如下:
2NH3(l)+CO2(g) H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
试回答下列问题:
(1)下列措施中有利于提高尿素的产率的是___________。
A.采用高温 B.采用高压 C.寻找更高效的催化剂
(2)合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵) (l) △H1
H2NCOONH4(氨基甲酸铵) (l) △H1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l) △H2
H2O(l)+H2NCONH2(l) △H2
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示:
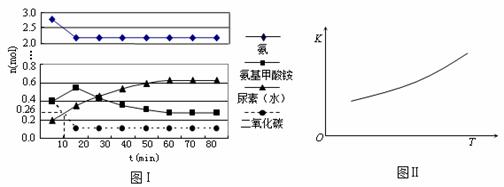
① 已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_____步反应决定。
② 反应进行到10 min时测得CO2的物质的量如图Ⅰ所示,则用CO2表示的第一步反应的速率v(CO2)=____________________
③ 第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H2 0
(填“>”“<”或“=”)
Ⅱ.以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如下表。
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 浓度 | 28.42 g/L | 1.6 g·L-1 |
| 排放标准 | pH 6~9 | 0.5 mg·L-1 |
表1.几种砷酸盐的Ksp 表2.工厂污染物排放浓度及允许排放标准
回答以下问题:
(3)若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol·L-1,
c(AsO43-)最大是 mol·L-1。
(4)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式 。
(5)在处理含砷废水时采用分段式,先向废水中投入适量生石灰调节pH到2,再投入适量生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
① 将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为 ;
②在pH调节到8左右才开始出现大量Ca3(AsO4)2沉淀的原因为
查看答案和解析>>
科目:高中化学 来源: 题型:
在0.lmol/L的HA溶液中存在如下电离平衡: HA A-+H+,对于该溶液,下列叙述正确的是
A-+H+,对于该溶液,下列叙述正确的是
A.滴加少量0.lmol/L HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减少
B.加水,溶液中所有离子浓度均减小
C.加入少量NaA固体,平衡向逆反应方向移动,溶液中c(OH-)增大
D.加入少量NaOH固体,平衡向正反应方向移动, 溶液中c(H+)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
把A、B、C、D四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若A、B相连,A为负极;C、D相连,D上有气泡逸出;A、C相连A极减轻;B、D相连,B为正极。则四种金属的活泼性顺序由大到小排列为( )
A. A>C>D>B B. A>C>B>D C. B>D>C>A D. A>B>C>D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com