
| A. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 双氧水加入稀硫酸和KI溶液:H2O2+2H++2I-═I2+2H2O | |
| C. | Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O |
分析 A.次氯酸为弱电解质,保留化学式;
B.双氧水加入稀硫酸和KI溶液生成碘和硫酸钾、水;
C.原子个数不守恒;
D.电荷不守恒.
解答 解:A.Cl2通入水中,离子方程式:Cl2+H2O═H++Cl-+HClO,故A错误;
B.双氧水加入稀硫酸和KI溶液,离子方程式:H2O2+2H++2I-═I2+2H2O,故B正确;
C.Na2O2溶于水产生O2,离子方程式:2Na2O2+2H2O═4Na++4OH-+O2↑,故C错误;
D.Na2S2O3溶液中加入稀硫酸,离子方程式:S2O32-+2H+═S↓+SO2+H2O,故D错误;
故选:B.
点评 本题考查离子方程式和电离方程式书写,明确物质的性质及离子方程式书写规则是解本题关键,注意离子方程式书写应符合客观事实、原子守恒、电荷守恒及转移电子守恒,题目难度不大.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:解答题
 有两研究性学习小组拟探究卤代烃的性质.查资料得知:溴乙烷的沸点为3.4℃,乙醇的沸点℃.
有两研究性学习小组拟探究卤代烃的性质.查资料得知:溴乙烷的沸点为3.4℃,乙醇的沸点℃.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制氯气,是在加热条件下,二氧化锰固体与稀盐酸反应 | |
| B. | 新制氯水中只含有Cl2和H2O分子 | |
| C. | 随着氯元素化合价的升高,氯的含氧酸的酸性逐渐增强 | |
| D. | 氯气可用作消毒剂和漂白剂,是因为氯气分子具有强的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{{1000{ρ_1}{ρ_2}ω}}{{{ρ_1}+4}}$mol/L | B. | $\frac{{1000{ρ_1}{ρ_2}ω}}{{36.5({ρ_1}+4)}}$mol/L | ||
| C. | $\frac{{1000{ρ_1}}}{182.5}$mol/L | D. | $\frac{{1000{ρ_1}{ρ_2}ω}}{182.5}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸、稀硝酸与铁反应均属于置换反应 | |
| B. | 实验室用铜和浓硝酸反应制取NO | |
| C. | CO2、SO2、NO2都能与H2O反应,且原理相同 | |
| D. | 三种元素均可以和氧元素形成多种氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:D>C | B. | 原子序数:b>a>c>d | ||
| C. | 离子的还原性:cCn->dD(n+1)- | D. | 离子的氧化性:aAn+>bB(n+1)+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IA族元素的金属性比IIA族元素的金属性强 | |
| B. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增强 | |
| C. | 第三周期元素的离子半径从左到右逐渐减小 | |
| D. | VIA族元素的氢化物中,稳定性最好的其沸点也最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应: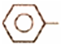 CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ CH=CH2(g)+H2(g)
CH=CH2(g)+H2(g)| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com