
| A. | 为了防止白色污染应将废旧塑料加以焚烧 | |
| B. | 加热能杀死H7N9禽流感病毒是因为病毒的蛋白质受热变性 | |
| C. | 富脂禽品包装中常放入活性铁粉袋,以防止油脂氧化变质 | |
| D. | 用K2FeO4代替Cl2处理饮用水时,既有杀菌消毒作用,又有净水作用 |
分析 A.焚烧废旧塑料,会导致大气污染;
B.加热可使蛋白质变性;
C.铁粉具有还原性;
D.K2FeO4具有强氧化性,且还原产物铁离子可水解生成胶体.
解答 解:A.焚烧废旧塑料,会导致大气污染,不利于环境保护,故A错误;
B.加热可使蛋白质变性,可用加热的方法杀菌消毒,故B正确;
C.活性铁粉具有还原性,富脂食品包装时,放入活性铁粉等抗氧剂,以防止油脂氧化变质,故C正确;
D.K2FeO4具有强氧化性,且还原产物铁离子可水解生成胶体,则用K2FeO4代替Cl2处理饮用水,既有杀菌消毒作用,又有净水作用,故D正确;
故选A.
点评 本题考查物质的性质与用途,为高频考点,把握物质的性质、发生的反应、性质与用途的关系为解答的关键,侧重分析与应用能力的考查,注意化学与生活、生产的联系,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 4.6mol•L-1 | B. | 5.7mol•L-1 | C. | 3.88mol•L-1 | D. | 18.4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
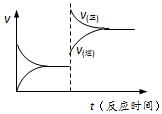 已知:
已知:| A. | 反应①使用催化剂,△H1减小 | |
| B. | 反应②生成物总能量低于反应物总能量 | |
| C. | 反应③一定能自发进行 | |
| D. | 反应③达到平衡后升高温度,v(正)、v(逆)的变化如图所示 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 113号元素的氧化物为碱性氧化物 | |
| B. | 115号元素位于第七周期VA族 | |
| C. | 含176个中子的Ts原子表示为${\;}_{117}^{176}$Ts | |
| D. | 118号元素的原子最外层有8个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | E3+的氧化性比M2+的氧化性强 | |
| B. | 在反应①中硫酸既表现了酸性、又表现了氧化性 | |
| C. | 我国是世界上最早使用反应②冶炼金属M的国家 | |
| D. | 在③反应中若不加稀硫酸可能看到红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ; B、C、E离子半径的由大到小的顺序为Cl->O2->Na+;(用离子符号回答) A、B气态氢化物沸点更高的是H2O;
; B、C、E离子半径的由大到小的顺序为Cl->O2->Na+;(用离子符号回答) A、B气态氢化物沸点更高的是H2O;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
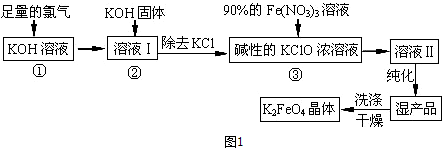
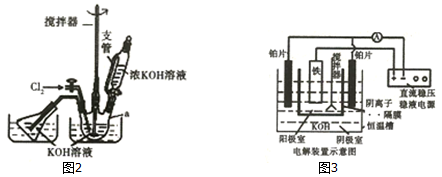
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com